El oxígeno es un gas incoloro e inodoro que condensa en un líquido azul pálido. Debido a que es una molécula de pequeña masa y apolar tiene puntos de fusión y ebullición muy bajos. Es el elemento más abundante en el planeta ya que supone el 21 % de la atmósfera (78% N2). En la corteza terrestre constituye el 46 % de la hidrosfera (H2O) y el 58 % de la litosfera (silicatos, carbonatos, fosfatos, sulfatos, etc.)
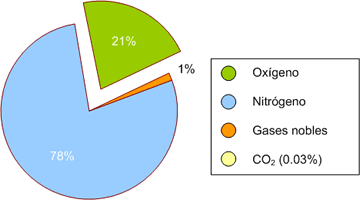
Figura 1. Composición aire
Formación del oxígeno atmosférico.
Los gases que constituían la atmósfera primitiva de la Tierra se produjeron en su mayor parte como consecuencia de erupciones volcánicas. Dichas emanaciones estarían formadas básicamente por el H2O y el CO2 pero no dioxígeno. El oxígeno elemental se tuvo que formar a partir de estos compuestos. Probablemente el oxígeno empezó a formarse por hidrólisis de H2O provocada por la radiación solar. Se piensa que alrededor de un 1% del oxígeno libre se pudo producir por este proceso. La mayoría del oxígeno se formó como consecuencia de la actividad fotosintética de las algas marinas. El aumento de la cantidad de oxígeno en la atmósfera propició también la formación de la capa de ozono estratosférico facilitando la evolución de la vida del ámbito marino a la superficie terrestre. Los organismos fotosintéticos, plantas, algas, constituyen la fuente renovadora del oxígeno atmosférico implicado en un complejo ciclo de consumo/regeneración. El O2 atmosférico se consume por la respiración de los seres vivos y tambien por procesos naturales (combustión) e industriales que producen CO2, siendo regenerado a partir del CO2 y H2O mediante la fotosíntesis.
Descubrimiento del oxígeno.
Quién primero lo preparó fue Scheele, un químico sueco, en 1772. Lo identificó como uno de los principales constituyentes del aire y lo llamó aire de fuego y aire de vitriolo. No obstante, a quien se considera generalmente como su descubridor es a Priestley, puesto que publicó sus resultados en 1774, mientras que Scheele retrasó su publicación hasta 1777. En su preparación original, Priestley calentó lo que hoy conocemos como óxido de mercurio, HgO, y observó el desprendimiento de un gas. A este gas lo denominó aire deflogistizado y observó que aumentaba la brillantez de una llama. Sin embargo, fue Lavoisier quien reconoció en el nuevo gas un elemento y lo llamó oxígeno en 1777(del griego oxy genes formador de ácidos).
Propiedades Físicas y Atómicas
El oxígeno posee tres isótopos naturales: 16-O (99,762%), 17-O (0,038%) y 18-O(0,200%).
| Descripción | |||
|---|---|---|---|
| Nombre | Oxígeno | Símbolo | O |
| Número atómico | 8 | Peso atómico | 15,9994 |
| Propiedades Electrónicas | Propiedades Físicas | ||
| Valencia | -2 | Densidad (g/ml) | 1,14 |
| Electronegatividad | 3,5 | Punto de ebullición ºC | -183 |
| Radio covalente | 0,73 | Punto de fusión ºC | -218,8 |
| Radio iónico (estado de oxidación) |
1,40 (-2) | ||
| Radio atómico | 1.40 Å | ||
| Estructura atómica | 1s22s22p4 | ||
| Potencial primero de ionización (eV) |
13,70 | ||
Naturaleza singular del oxígeno
En varios grupos de la Tabla Periódica hay marcadas diferencias entre el primer elemento y los demás. Cuando el oxígeno se compara con el azufre y los restantes elementos del grupo, las diferencias se hacen notorias y vienen ocasionadas por:
- El pequeño tamaño del oxígeno y sus iones.
- La menor electronegatividad de los elementos O → Po que implica menor carácter iónico en sus enlaces. El O es el segundo elemento más electronegativo por detrás del F. Esto se traduce en una gran importancia del enlace de H para algunos compuestos con O y prácticamente nula para los demás.
- El oxígeno no puede ampliar octeto, mientras que el azufre puede acomodar hasta 18 e- en la capa n = 3. Esto implica que los índices de coordinación en el azufre sean muy variados y elevados.
Consecuencias:
1. En los compuestos con oxígeno hay un predominio de los enlaces múltiples. En la tabla siguiente se dan las contribuciones medias σ y π a los enlaces dobles:
Contribuciones σ/π a un enlace doble (KJ mol-1)
C-C |
N-N |
O-O |
F-F |
|---|---|---|---|
335/295 |
160/395 |
145/350 |
155/- |
Si-Si |
P-P |
S-S |
Cl-Cl |
195/120 |
200/145 |
270/155 |
243/- |
Ge-Ge |
As-As |
Se-Se |
Br-Br |
165/110 |
175/120 |
210/125 |
188/- |
A la vista de la tabla se pueden hacer algunas consideraciones
- El enlace sencillo (σ) O-O es muy débil (comparado con el C-C por ejemplo).
- El oxígeno puede utilizar sus orbitales p para formar fuertes enlaces dobles. La formación de un enlace doble O=O está mucho más favorecida que la formación de un enlace doble S=S o Se=Se (el aumento de tamaño hace que el solapamiento pπ-pπ sea menos eficaz y la formación de enlaces dobles está prácticamente restringida a O y S). Mientras que la química del O está gobernada por la tendencia a formar enlaces múltiples (presentes por ejemplo en el dioxígeno o en el ozono), la de S y el resto de los elementos del grupo está gobernada por la presencia mayoritaria de enlaces sencillos (S8, Se8, α-Se).
- Los dobles enlaces son más estables cuando se dan entre dos átomos con pequeña diferencia de electronegatividad o cuando la suma de electronegatividades sea elevada
Enlace |
O (KJ mol-1) |
S (KJ mol-1) |
|---|---|---|
X-X |
136 |
213 |
X=X |
496 |
317 |
2. El oxígeno forma muy pocos compuestos homo-catenados. Mientras que en el oxígeno la tendencia a la homocatenación es prácticamente inexistente, el S (y en menor medida el selenio) forma innumerables compuestos con enlaces S-S (despues del C es el elemento más versátil en cuanto a la formación de homocadenas).
3. La elevada electronegatividad del oxígeno posibilita la existencia de puentes de hidrógeno y impone carácter iónico en muchas de sus combinaciones (óxidos y peróxidos).
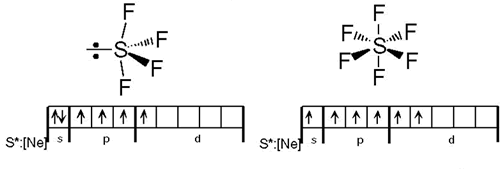
4. El oxígeno no posee orbitales d de baja energía. Esto limita la coordinación a un máximo de 4. Mientras el oxígeno sólo forma un óxido con el flúor, (OF2), el S forma varios (algunos como el SF6 n.c = 6). Podemos racionalizar la formación de este compuesto desde el punto de vista de la teoría de Enlace de Valencia; para formar los 6 enlaces covalentes, el S debe adoptar una hibridación sp3d2. La ausencia del análogo compuesto de oxígeno se achaca a la ausencia de orbitales d de baja energía.