Conceptos fundamentales de los sistemas termodinámicos
La Termodinámica se desarrolla a partir de cuatro Principios o Leyes:
- Principio Cero: permite definir la temperatura como una propiedad.
- Primer Principio: define el concepto de energía como magnitud conservativa.
- Segundo Principio: define la entropía como magnitud no conservativa, una medida de la dirección de los procesos.
- Tercer Principio: postula algunas propiedades en el cero absoluto de temperatura.
Por ahora ninguna de estas formulaciones tiene una forma útil, y las trataremos en detalle solamente después de haber presentado las definiciones rigurosas de los conceptos necesarios. Un problema típico entre aquellos que se tratan en Termodinámica consiste en calcular un conjunto de propiedades de un sistema a partir de otro conjunto de propiedades. Muy raramente se resuelven los problemas mediante el método (directo pero engorroso) de construir mentalmente hipotéticas máquinas de movimiento perpetuo, llamaremos máquina de movimiento perpetuo a aquella máquina que produzca trabajo sin que tenga lugar otro efecto externo.
En cambio se suelen usar procedimientos matemáticos abstractos que se obtienen de una vez por todas y luego se utilizan para resolver los problemas. Estos procedimientos indirectos son muy eficientes, pero no hay que olvidar que su fundamento reside en las leyes básicas. La Termodinámica se ocupa de estudiar procesos y propiedades macroscópicas de la materia y no contiene ninguna teoría de la materia. Por lo tanto no nos dice nada acerca de la constitución de la materia.
Como las variables con la cuales se trabaja son siempre macroscópicas, no es posible obtener de la Termodinámica la información a escala microscópica acerca del sistema, sea en lo referente a su estructura como a sus procesos internos.
Si bien ésta es una restricción, en compensación significa que la Termodinámica tiene gran generalidad. El hecho de evitar deliberadamente toda referencia a la estructura de la materia otorga a la Termodinámica clásica una dureza que a primera vista puede parecer poco agradable. Pero este camino tiene la virtud de poner en evidencia precisamente aquellas partes de una teoría física que no dependen de teorías particulares de la materia.
Por esto la Termodinámica tiene un aspecto extraordinariamente práctico, puesto que se la puede aplicar con toda confianza a sistemas que son demasiado complicados para ser analizados mediante otras teorías. Existe además una rama denominada Termodinámica Estadística en la que se pueden relacionar las propiedades a escala microscópica del sistema con propiedades macroscópicas que estudia la Termodinámica clásica.
Definiciones y conceptos básicos
La Termodinámica clásica divide al universo en el sistema y el ambiente, separados por una frontera. Esta visión simplificada permite estudiar la transferencia de energía en el Universo. En esta primera unidad se verán las principales definiciones y consideraciones que permiten la descripción de los sistemas termodinámicos.
Εργον (érgon) es el padre de la energía; la energía, palabra de origen griego que deriva del vocablo en (dentro) – érgon (acción, trabajo), significa pues fuerza en acción, o capacidad para producir trabajo, es el protagonista principal de la Termodinámica. Es en consecuencia la Ciencia que estudia la conversión de unas formas de la energía en otras. En su sentido etimológico, podría decirse que trata del calor y del trabajo, pero por extensión, de todas aquellas propiedades de las sustancias que guardan relación con el calor y el trabajo.
La Termodinámica se originó a partir de consideraciones acerca de calor y temperatura, y emplea términos y conceptos del lenguaje corriente. Sin embargo esas mismas palabras y conceptos, cuando se usan en Termodinámica son abstracciones de los conceptos ordinarios y tienen significados bien precisos que pueden diferir del uso común. Por eso hace falta introducir algunas definiciones y conceptos básicos, de los cuales quizás el más fundamental es el de equilibrio.
La Teoría divide al universo en forma simple considerando como el sistema a aquella parte del universo que se encuentra en estudio. El sistema está rodeado por los alrededores y el límite de separación entre ambos constituye la frontera.
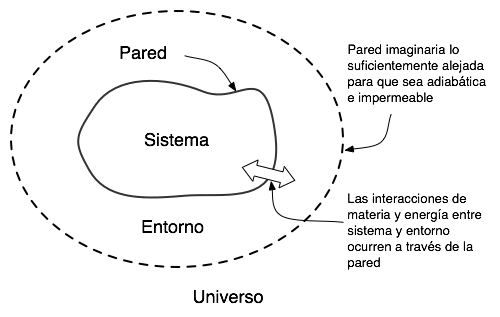
figura 1.1.
Toda intercambio entre el sistema y los alrededores implica algún tipo de transferencia que se realiza a través de la frontera. De esta manera, los alrededores no están constituidos por todo el Universo, sino solamente por aquella parte del mismo que afecta o se ve afectada por el sistema.
La definición del sistema y de los alrededores constituye el punto de partida para el análisis de cualquier problema termodinámico.
Por ejemplo, consideremos el caso de un recipiente sumergido en un baño de agua.
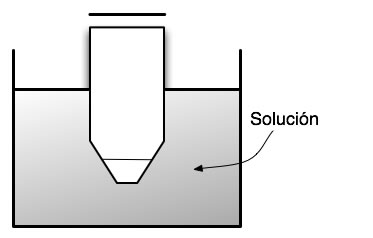
figura 1.2.
Si nuestro interés es estudiar la solución contenida en este recipiente, entonces esta solución constituye el sistema. Lo que suceda en esta solución podrá afectar o será afectado por el baño de agua. Por ejemplo, si calentamos el baño, habrá una transferencia de calor desde el baño hacia la solución a través del vidrio. Por lo tanto, el recipiente de vidrio constituye la frontera entre el sistema y los alrededores. Si por el contrario la solución experimenta un aumento de temperatura, entonces la transferencia de calor se producirá desde la solución hacia el baño de agua.
La fracción del universo que se encuentra por fuera del baño (la mesada del laboratorio, el salón de clase, etc.) no se ve afectado por el sistema, y tampoco afecta al mismo. Por lo tanto, los alrededores están solamente constituido por el baño, y no por el resto del universo tal cual lo entendemos intuitivamente.
Por lo tanto sistema es aquella única porción del universo en la cual estamos interesados. Típicos sistemas termodinámicos pueden ser: una cierta cantidad de gas, un líquido y su vapor, una mezcla de dos líquidos, una solución, un sólido cristalino, etc.
Luego definimos el ambiente o medio ambiente; todo lo que se encuentra en el universo, con excepción del sistema, se denomina ambiente. Es decir es la parte del universo próxima al sistema y que se ve afectada en alguna medida por los procesos que ocurren en el sistema.
El sistema y el ambiente están separados por un límite. Este límite es la pared, contorno o borde real o imaginario que separa el sistema del ambiente. En Termodinámica se supone que el límite de un sistema es una superficie matemática, a la que atribuimos ciertas propiedades ideales como rigidez, impermeabilidad y otras que describiremos más adelante. Los límites reales tan sólo se aproximan a las propiedades de los límites ideales de la Termodinámica. Un sistema se dice cerrado cuando está rodeado por un límite impermeable a la materia, y abierto cuando está rodeado por un límite permeable.
De modo que los límites permiten establecer una clasificación de los Sistemas.
Los sistemas se clasifican de acuerdo con la permeabilidad de la frontera al pasaje de: materia, calor o trabajo.
Un sistema abierto es aquel en el cual tanto la materia, el calor y el trabajo pueden atravesar libremente. En nuestro ejemplo, basta con que el recipiente esté destapado para que sea un sistema abierto.
Un sistema cerrado posee una frontera que impide el pasaje de materia pero sí permite el pasaje de calor y trabajo. En nuestro ejemplo, si cerramos el recipiente podemos impedir que se produzca un pasaje de materia, pero no impediremos que se de un intercambio de calor y trabajo a través de la frontera.
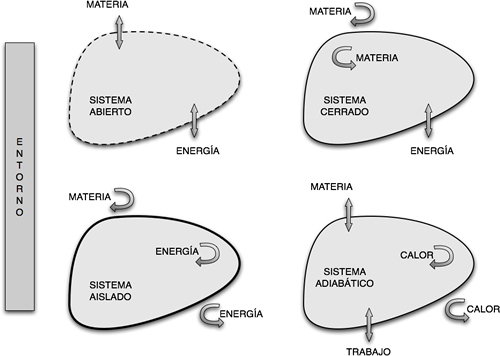
figura 1.3.
En termodinámica, las paredes de separación entre sistemas pueden clasificarse en dos tipos extremos: paredes adiabáticas y paredes diatermanas o diatérmicas.
Un sistema con paredes adiabáticas impide el pasaje de calor y materia, aunque sí permite el pasaje de trabajo. Un ejemplo de este sistema es un termo, que tiene paredes de un material tal que impide el pasaje de calor y materia a través del mismo. Finalmente un sistema aislado impide el pasaje de materia, calor y trabajo.
Luego corresponde definir el concepto de universo, es todo lo accesible a nuestro experimento. Para el termodinámico, el universo está formado por el sistema examinado y su entorno con el que es capaz de interaccionar en su evolución:
UNIVERSO = SISTEMA + ENTORNO
Por convenio, el universo para el termodinámico es un sistema aislado. El Universo de la cosmología (con U mayúscula) no tiene por qué coincidir con el universo de la Termodinámica.
SISTEMA |
CLASIFICACIÓN |
COMENTARIOS |
|---|---|---|
| Una Célula | abierto | Hay intercambio de materia con los alrededores, así como de calor y trabajo |
| Un huevo de gallina | abierto | La cáscara del huevo permite el pasaje de gases. Este sistema tampoco es adiabático, pues permite el pasaje de calor de la madre. |
| Una cápsula espacial | cerrado | No se permite el intercambio de materia con el exterior, pero sí recibe energía desde fuera (como radiación) |
| El Universo | aislado | Por definición. |
Propiedad, Estado
Propiedad es cualquier magnitud física evaluable de un sistema, es decir medible. Cada sistema puede ser referido en función de un pequeño número de variables de estado o propiedades. Solamente pueden ser clasificadas como propiedades aquellas características del sistema que no dependen de la forma en que fue adquirida. En otras palabras, una propiedad del sistema no depende de la historia del sistema ni de su entorno, sino de las condiciones del mismo en el momento de la medida. Las propiedades pueden ser extensivas o intensivas.
Propiedades Extensivas e Intensivas
Propiedad extensiva son aquellas que dependen del tamaño del sistema, por ejemplo: la masa, el volumen, y todas las clases de energía, son propiedades extensivas o aditivas, de manera que cuando las partes de un todo se unen, se obtiene el valor total. Si un sistema está constituido por N subsistemas, entonces el valor de una propiedad extensiva X para el sistema total, siendo Xi la propiedad extensiva del subsistema i, será:
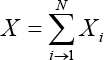
Para designar las propiedades extensivas se utilizan letras mayúsculas (la masa m es una excepción importante).
Las propiedades intensivas son aquellas que son propias del sistema, es decir no dependen del tamaño del sistema, si un sistema se divide en dos partes, una propiedad intensiva mantiene el mismo valor en cada parte que poseía en el total, por lo tanto se definen en un punto. Son independientes del tamaño, masa o magnitud del sistema: por ejemplo la presión, temperatura, viscosidad y altura.
Las propiedades extensivas se convierten en intensivas si se expresan por unidad de masa (propiedad específica), de moles (propiedad molar) o de volumen (densidad de propiedad).
Las propiedades intensivas se representan con letras minúsculas, con la excepción de la temperatura T.
Por ejemplo, la energía se puede definir de las siguientes maneras:
Energía (variable extensiva, aditiva): E [J]
Energía específica (energía por unidad de masa):
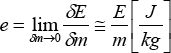
Energía molar (energía por unidad de moles):
![]()
Densidad de energía (energía por unidad de volumen):
![]()
Variables Termodinámicas
Las variables termodinámicas son las magnitudes que estimamos necesario o conveniente especificar para dar una descripción macroscópica del sistema. La mayoría de esas magnitudes provienen de otras ramas de la física. Por ejemplo la presión proviene de la Mecánica, las intensidades de campo eléctrico y magnético del Electromagnetismo, etc. Por consiguiente no podemos dar una definición completa y detallada del concepto de variable termodinámica, y por ahora nos tenemos que conformar con algunos ejemplos. Para un sistema que consiste en un gas o un líquido, o una mezcla de diferentes gases o líquidos, las variables termodinámicas son: las masas de las diferentes sustancias presentes, la presión, el volumen y la temperatura.
En un sistema en que se consideran superficies o películas líquidas, las variables correspondientes son la tensión superficial, el área superficial y la temperatura.
El estudio termodinámico de un sistema magnético incluiría probablemente como variables la intensidad del campo magnético, la magnetización de la materia del sistema y la temperatura.
En estos ejemplos dimos sólo tres variables (además de la masa) para cada sistema, pero puede haber más. En todos esos grupos de variables la única en común es la temperatura, que luego estudiaremos en detalle. Las demás provienen de ramas de la física ajenas a la Termodinámica.
Algunos ejemplos de propiedades intensivas y extensivas se resumen en la siguiente tabla:
TIPO |
EXTENSIVA |
INTENSIVA |
Relacionadas
con la masa |
Masa |
Densidad Concentración de un soluto |
P-V-T |
Volumen |
Volumen
específico (vol/masa) Volumen molar (vol/num.de moles) Presión Temperatura |
Energía
térmica |
Capacidad
calorífica
Energía Entropía Entalpía Energía libre |
Calor
específico (cap.cal/masa) Energía molar Entropía molar Entalpía molar Potencial químico |
Otras
propiedades |
Constante
dieléctrica Índice de refracción Viscosidad |
|
Descripción matemática de un sistema
Una propiedad de un sistema puede ser definida en función de las restantes propiedades a través de una ecuación diferencial. Esto equivale a decir “una propiedad o función de estado es una función de variables de estado”.
Sea Φ la propiedad de un sistema, que depende de las propiedades x e y. Si las propiedades x e y definen completamente al sistema, entonces Φ = Φ(x,y) es una función de estado. De esta manera, un pequeño cambio en la propiedad Φ (dΦ) puede explicarse por pequeños cambios en las propiedades x (dx) e y (dy) de acuerdo con:
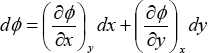
Esta expresión se denomina diferencial exacta, y se caracteriza porque su valor (dΦ) depende exclusivamente de los valores iniciales y finales de sus variables (x e y). Esta ecuación diferencial total nos proporciona una forma de calcular los cambios de una función de estado a través de los cambios combinados de las variables independientes.
Una diferencial inexacta es una función matemática cuyo valor ya no depende exclusivamente de los valores iniciales y finales de sus variables, sino que además, depende del camino seguido para producir estos cambios en los valores de las variables.
Para determinar si una diferencial es exacta o inexacta, se aplica el criterio de Euler. Cualquier diferencial, independientemente de su exactitud o no, puede ser escrita como:
![]()
donde M y N son funciones de las propiedades x e y.
Si dΦ es una diferencial exacta, deberá existir una función Φ = Φ(x,y) tal que se cumpla que:
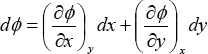
Comparando las dos últimas ecuaciones, se deduce que:
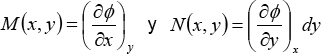
entonces dΦ es diferencial exacta si y sólo si cumple la regla de Schwartz de las segundas derivadas cruzadas, las derivadas segunda de estas funciones deben ser iguales, pues:
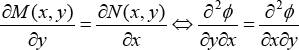
Por lo tanto, el criterio de Euler para establecer la exactitud de una diferencial es:
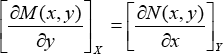
Resumiendo: una propiedad o función de estado es una función de variables de estado. Para que una función Φ sea una función de estado, es necesario y suficiente que la diferencial dΦ sea una diferencial exacta. Las siguientes cuatro afirmaciones son equivalentes; si una de ellas se cumple, las otras tres también se cumplen:
- Φ es una función de estado;
- dΦ es una diferencial exacta;
- ∫dΦ = 0 ;
- ∫dΦ = Φ − Φ , independiente del camino recorrido.
Coeficientes Termodinámicos
Los coeficientes termodinámicos son relaciones entre propiedades termodinámicas. Matemáticamente son derivadas parciales de una variable respecto de otra. Ejemplos:
- Coeficiente de dilatación lineal,
![]()
- Calor específico a presión constante,
![]()
- Coeficiente de compresibilidad isotérmico,
![]()
Ver también Termodinámica en la sección Química