Estado del sistema
Cuando se han especificado las variables necesarias para describir al sistema se dice que se ha particularizado el estado del sistema. Un sistema se encuentra en estado definido cuando todas sus propiedades poseen valores específicos. Si a su vez estos valores no cambian con el tiempo, el sistema se dice que está en equilibrio termodinámico, para el cual no existe un flujo de masa o energía. El equilibrio termodinámico se establece una vez que el sistema alcanza otro tipo de equilibrios.
Para comprobar si un sistema está en equilibrio habría que aislarlo (imaginariamente) y comprobar que no evoluciona por sí solo.
Ejemplo de equilibrio mecánico: el punto P tiene una posición de equilibrio que viene dada por la magnitud de las tres masas y la distancia entre las poleas (leyes de la estática: equilibrio de fuerzas). El punto no cambia de posición si no interviene alguna interacción desde el exterior. Una pequeña perturbación (un pequeño aumento δm de una de las masas, o un cambio δx de las posiciones de las poleas) desplaza la posición de P, pero si cesa la acción desde el exterior el punto vuelve a su posición de equilibrio.(Figura 1.4.)
Cuando no hay ninguna fuerza sin equilibrar en el sistema y, por consiguiente, no se ejercen fuerzas entre él y el ambiente que lo rodea, se dice que el sistema se encuentra en equilibrio mecánico. Si no se cumplen estas condiciones, el sistema sólo o el sistema y su medio ambiente experimentarán un cambio de estado, que no cesará hasta que se haya restablecido el equilibrio mecánico.
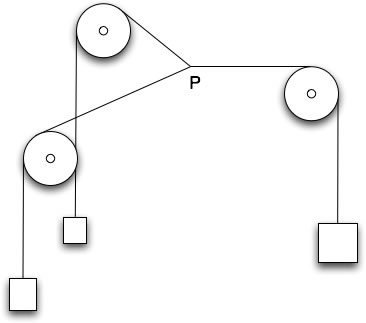
figura 1.4.
Si un sistema en equilibrio mecánico no tiende a experimentar un cambio espontáneo en su estructura interna, tal como una reacción química, o la difusión de materia de una parte del sistema a otro (aunque sea lenta), el sistema se encuentra en equilibrio químico. Un sistema que no se halle en equilibrio químico experimenta un cambio de estado que, en algunos casos, es extremadamente lento. El cambio cesa cuando se ha alcanzado el equilibrio químico.
Existe un equilibrio térmico cuando no hay cambio espontáneo en las variables de un sistema en equilibrio mecánico y químico si se le separa del exterior mediante una pared diatérmica. En el equilibrio térmico, todas las partes del sistema se encuentran a la misma temperatura, y esta temperatura es igual a la del medio ambiente. Si estas condiciones no se cumplen, tendrá lugar un cambio de estado hasta alcanzar el equilibrio térmico.
Para el caso en que las propiedades del sistema no cambien con el tiempo, pero igual existe un flujo de materia y/o energía, se dice que el sistema se encuentra en estado estacionario.
El Equilibrio, es un concepto fundamental de la Termodinámica. La idea básica es que las variables que describen un sistema que está en equilibrio no cambian con el tiempo. Pero esta noción no es suficiente para definir el equilibrio, puesto que no excluye a procesos estacionarios (principalmente varios procesos en que hay flujos) que no se pueden abordar con los métodos de la Termodinámica clásica. En los procesos estacionarios debe haber continuamente cambios en el ambiente para mantener constantes los valores de las variables del sistema. Para excluirlos se usa entonces una definición más restrictiva: un sistema está en equilibrio si, y solo si, está en un estado desde el cual no es posible ningún cambio sin que haya cambios netos en el ambiente.
La Termodinámica clásica se ocupa solamente de sistemas en equilibrio. Veremos más adelante cómo se pueden tratar sistemas fuera del equilibrio.
El equilibrio es una abstracción pues los sistemas reales no están nunca en estricto equilibrio. Pero siempre y cuando las variables que describen al sistema y al ambiente que interactúa con él no varíen apreciablemente en la escala de tiempo de nuestras mediciones, se puede considerar que el sistema está en equilibrio y aplicarle las consideraciones termodinámicas pertinentes.
Proceso
Un sistema experimenta un proceso, cuando se verifica un cambio de estado. Un cambio de estado puede conseguirse por distintos procesos.
Proceso cíclico
El estado final coincide con el inicial.Proceso cuasiestático
Todos los estados intermedios del proceso son estados de equilibrio. Este proceso realmente no existe, es ideal o teórico. Puede aproximarse tanto más cuanto la causa del proceso varía en cantidades cada vez más pequeñas. Entonces cada nuevo estado producido, puede considerarse de equilibrio y viene definido por sus coordenadas y puede aplicársele las ecuaciones que las vinculen. La representación en un diagrama vendrá dada por una curva continua.
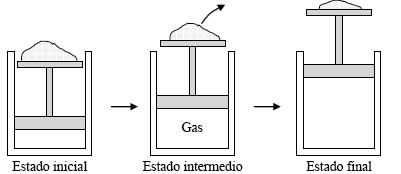
figura 1.5a
Proceso cuasiestático de expansión de un gas. La fuerza exterior (peso de la arena) se va reduciendo infinitesimalmente. Todos los estados intermedios son de equilibrio.
Proceso no estático
Cuando no cumple las condiciones anteriores. Son los procesos de igualación, ver siguiente figura:
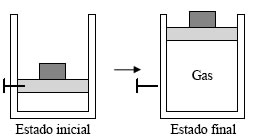
figura 1.5.b.
Proceso no estático de expansión de un gas. Al retirar la fijación, el sistema deja de estar en equilibrio, y evoluciona por sí solo hasta alcanzar un nuevo estado de equilibrio. Los estados intermedios no son de equilibrio.
Proceso reversible
Es un proceso cuasiestático, que puede ser llevado de nuevo al estado inicial pasando por los mismos estados intermedios que el proceso directo, y sin que al final, ni en el sistema ni en el medio rodeante, quede ningún efecto residual que pueda revelar que se ha verificado el proceso. Para que esto último suceda, no debe haber rozamientos ni deformaciones, lo que se llaman efectos disipativos. Por último, adelantaremos que no habrá degradación de la energía y por ello ninguna generación o producción de entropía.
Proceso irreversible
Son los procesos reales. En ellos siempre habrá degradación de energía y generación de entropía. Pueden ser de dos tipos:
a) Cuando se verifiquen por cambios no estáticos (procesos de igualación), tengan o no efectos disipativos.
b) Cuando haya efectos disipativos, aunque se verifiquen a través de cambios cuasiestáticos.
Límite adiabático
Se dice que un límite es adiabático cuando el estado del sistema se puede cambiar únicamente moviendo el límite o bien colocando al sistema en un campo de fuerzas exteriores (por ejemplo campos eléctricos, magnéticos o gravitacionales). Esta noción será crucial en nuestra próxima formulación de la Primera Ley. A veces se suele definir el límite adiabático como aquél que es impermeable al flujo de calor. Ambas definiciones son finalmente equivalentes, pero preferimos la primera porque es muy difícil dar a priori una definición precisa del concepto de calor. Es mejor que la definición de calor dependa de la presente definición de límite adiabático que no a la inversa. Obsérvese que el movimiento que mencionamos en nuestra definición incluye también movimientos tangenciales y de corte. La elección de la pared no siempre es trivial. Por ejemplo, una rueda con paletas que está agitando a un fluido (donde el fluido es el sistema que estamos considerando); en este caso conviene acordar el límite en la superficie de las paletas, porque de esta forma podemos considerar a la agitación como resultado del movimiento del límite.
Límite diatérmico
Se dice que un límite es diatérmico cuando permite que el estado del sistema se modifique sin que haya movimiento del límite. La manera usual de definirlo es que un límite es diatérmico cuando permite el flujo de calor a través de él. De nuevo, preferimos evitar esta segunda definición debido a la dificultad de definir calor.
A continuación daremos algunas definiciones no tan básicas, pero importantes en muchas aplicaciones.
Sistema homogéneo
Un sistema se dice homogéneo cuando (en ausencia de fuerzas exteriores) sus variables termodinámicas son constantes a través de todo el sistema. Si hay campos de fuerzas, esta definición se puede ampliar admitiendo que las variables pueden variar de un punto a otro del sistema, siempre y cuando esas variaciones sean continuas. Por ejemplo, una columna de gas en un campo gravitacional se puede considerar homogénea aunque su densidad no sea uniforme.
Sistema heterogéneo
Un sistema en el cual las variables termodinámicas varían de un lugar a otro en forma discontinua se dice que es heterogéneo. Por ejemplo, un sistema constituido por hielo y agua en equilibrio es heterogéneo. Las discontinuidades se producen en las interfases sólido-líquido.
Fase
Muchas veces conviene dividir un sistema heterogéneo en subsistemas, llamados fases, imaginando nuevos límites en los lugares donde ocurren las discontinuidades. En consecuencia, una fase es un subsistema homogéneo. No es necesario que todas las partes de una fase sean adyacentes. Por ejemplo, un sistema que consiste de hielo y agua se considera un sistema de dos fases, sea que el hielo esté en un único trozo o dividido en varios fragmentos.
Sustancia pura
Sustancia pura es un material formado por un sólo constituyente, en oposición a una mezcla. Sustancia pura no significa sustancia químicamente pura: sustancia pura es la que, en el intervalo de propiedades estudiado, no se separa en sus componentes. Por ejemplo, en procesos físicos (calentamiento o enfriamiento, compresión o expansión) a temperatura ambiente o superior, el aire puede considerase una sustancia pura; pero en procesos químicos (reacciones de combustión) o a bajas temperaturas (cuando se forma aire líquido al licuarlo), es necesario considerar el aire como una mezcla de sus componentes (oxígeno, nitrógeno, etc.).
Dimensiones y unidades
Nomenclatura de magnitudes intensivas y extensivas
Magnitudes extensivas
Por ejemplo: V (volumen), E (energía), U(energía interna) ó A (área), se expresan con mayúsculas. La masa y el número de moles se denominan m y N.( Emplearemos N mayúscula para referirnos al número de moles para evitar una conflicto de notación con el llamado exponente politrópico n de procesos en gases)
Magnitudes intensivas específicas
Por ejemplo: v (volumen específico ≡ V/m), ρ (densidad ≡ m/V) ó u (energía interna específica ≡ U/m), se expresan en minúsculas. Las magnitudes intensivas puras, presión y temperatura (P y T), en mayúsculas, son las únicas excepciones.
Las magnitudes intensivas molares, por ejemplo: v (volumen molar ≡ V/N), ρ (densidad molar ≡ N/V) ó u (energía interna molar ≡ U/N), se emplean en minúsculas y con raya superior. No obstante, con frecuencia se prescindirá de la raya superior, y las unidades (molar o específica) se deducen del contexto.
Volumen, volumen específico y densidad
Estas propiedades se pueden definir de la siguiente manera:
Volumen (V) es el espacio que ocupa una sustancia; se mide en metros cúbicos (m3).
Volumen específico (v) es el espacio que ocupa la unidad de masa de una sustancia; se mide en metros cúbicos por kilogramo (m3/kg).
Densidad (ρ) es la masa de la unidad de volumen de una sustancia; se mide en kilogramos por metro cúbico (kg/m3).
De las definiciones se deducen las siguientes relaciones:
v = V/ m ; ρ = m/V y v = 1/ρ
Presión
La presión se define como la fuerza por unidad de superficie ejercida por un fluido sobre una superficie real o imaginaria, en dirección normal a la superficie. En unidades SI la presión se mide en newton por metro cuadrado (N/m2), unidad denominada Pascal (Pa). En relación con la presión atmosférica, que es una referencia habitual, el N/m2 resulta una unidad demasiado pequeña, por lo que se suele utilizar el bar, donde
1 bar = 105 N/m2 = 0,1 MPa = 100 kPa
1 atm = 101 325 N/m2 = 1,01325 bar = 101,325 kPa
En el caso de un gas, la presión es el resultado de los impactos de las moléculas del gas contra la pared: Como las moléculas se mueven en todas las direcciones, la presión es la misma con independencia de la orientación de la pared donde se mide, la presión es una magnitud escalar. (ver figura 1.6).
Para gases formados por mezcla de varias sustancias, la presión parcial es la contribución de cada gas a la presión total de la mezcla. Puede considerarse que la presión parcial de un gas es el resultado de las colisiones de las moléculas de ese gas contra la pared del recipiente.

figura 1.6.
La presión de los gases es el resultado de las colisiones de las moléculas con la pared: depende del número de colisiones y de la componente normal de la fuerza de cada colisión, por unidad de superficie. En ausencia de efectos gravitatorios, la presión es la misma en todas las superficies, con independencia de su orientación.
En el caso de líquidos, la presión se debe a la fuerza de la gravedad del líquido (peso): se denomina presión hidrostática. Atendiendo a la figura siguiente, la presión en el punto 2 será la presión atmosférica P0 más la fuerza ejercida por el peso de la columna de líquido, por unidad de área:
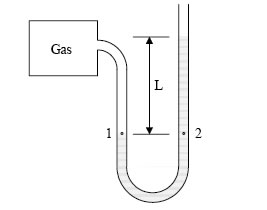
figura 1.7.
Manómetro para la medida de presiones. La medida se basa en que los puntos 1 y 2 están a la misma presión: Pgas = P1 = P2 = Patm + ρgL.
![]()
El término ρgL es en general el valor de la presión relativa del fluido, sea líquido o gas.
Conviene distinguir entre presión absoluta y presión manométrica. En la Figura anterior se representa un manómetro para la medida de presiones. La medida de la presión se basa en la igualdad de presión para puntos situados a la misma altura, vasos comunicantes, P1 = P2.
La presión manométrica del gas es ρgL, siendo ρ la densidad del líquido del manómetro, g la aceleración de la gravedad y L la altura manométrica. L puede ser negativo, luego la presión manométrica puede ser negativa. La presión absoluta del gas es la manométrica más la atmosférica, cuando hacemos este razonamiento se supone que la densidad del líquido manométrico ρ no cambia con la presión (líquido incompresible), y que la presión hidrostática del gas es despreciable (la presión del gas es idéntica a P1).
Pman = ρgL
P = P0 + Pman > 0
Hay medidores de presión cuya medida es la presión manométrica (presión relativa), y otros miden la presión absoluta.
Cambio en las propiedades de un sistema
Cuando un sistema cambia de un estado a otro, necesariamente alguna(s) de la(s) propiedad(es) del sistema ha(n) sufrido algún cambio. Se denomina proceso al cambio de alguna de las propiedades del sistema.
Para que un proceso tenga lugar, es necesario que algo atraviese la frontera del sistema, ya sea calor, trabajo, materia o una combinación de ellos. Como consecuencia de este pasaje, las propiedades del sistema cambiarán.
Un proceso puede realizarse en forma reversible o irreversible. La diferencia entre ambos es que un proceso reversible se lleva a cabo a través de una sucesión de equilibrios, cada uno de los cuales difiere del anterior en un cambio infinitesimal de una variable de estado. Por su parte, un proceso irreversible se lleva a cabo produciendo un cambio finito de una de las variables de estado, de manera que el valor de las otras variables no puede ser especificado en todo momento. Obviamente, un proceso reversible puede ser revertido en todo momento, mientras que una irreversible no.
Cuando se lleva a cabo un cambio de las propiedades del sistema desde un estado inicial a uno final, ya sea en forma reversible o irreversible, las propiedades del sistema en el estado inicial y final son las mismas para ambos procesos. Sin embargo, la cantidad de calor y trabajo que atravesó la frontera son diferentes para ambos procesos. Por lo tanto, las propiedades de un sistema no dependen de la forma en que se llegó a ese estado, mientras que la cantidad de energía involucrada en un cambio de estado depende de la forma en que se llevó a cabo dicho proceso.
Tomemos el siguiente ejemplo. Consideremos una persona que desea bajar una escalera. En principio existen dos formas en que lo pueda hacer: i) bajando escalón por escalón, y ii) saltando desde el primer escalón hasta el último. En ambos casos, la diferencia en la energía potencial de la persona será la misma, puesto que la altura que ha descendido es la misma. Sin embargo, cuando baja la escalera paso a paso, la persona puede ir un escalón hacia delante o hacia atrás, sin diferencias significativas en su esfuerzo. Por otra parte, la posición de la persona se conoce en todo momento. Esta forma de bajar la escalera puede, entonces, aproximarse a un proceso reversible. En el segundo caso, no existe la posibilidad de que la persona puede ir hacia atrás en algún momento de su trayectoria, y su salto hacia el final de la escalera será irreversible.
Conclusiones
Hemos visto, entonces, que el Universo puede ser adecuadamente descrito desde el punto de vista termodinámico si lo consideramos dividido en dos partes, el sistema y el ambiente, separadas entre sí por una frontera. El sistema, la parte del Universo que nos interesará estudiar, puede ser descrito a través de sus propiedades, las que se relacionan entre sí a través de ecuaciones de estado. A su vez, el sistema puede experimentar diversos procesos que produzcan cambios en el valor de sus propiedades.
Cuando un sistema se encuentra completamente descrito por sus propiedades, se obtiene una función de estado, cuyo valor depende exclusivamente del valor de sus propiedades en los estados inicial y final.
El calor y el trabajo no caracterizan a un sistema, sino que constituyen el medio por los cuales se puede modificar los valores en las propiedades de un sistema. En este sentido, pueden fluir a través de la frontera entre el ambiente y el sistema y viceversa. El valor del calor y del trabajo que se ha intercambiado depende de la forma en que se hizo este intercambio, y por lo tanto, no puede ser expresado a través de una diferencial exacta.