Generalidades.
A temperaturas altas, los polímeros se vuelven líquidos muy viscosos en los que las cadenas están constantemente en movimiento cambiando su forma y deslizándose unas sobre las otras. A temperaturas muy bajas, el mismo polímero serpia un sólido duro, rígido y frágil.
El polímero puede solidificarse formando un sólido amorfo o uno cristalino. Como se sabe los polímeros con fuertes irregularidades en su estructura tienden a formar sólidos amorfos y los polímeros con cadenas muy simétricas tienden a cristalizar, por lo menos parcialmente.
La línea ABCD corresponde a un polímero completamente amorfo. A temperaturas altas está en forma de un líquido viscoso, y al enfriarlo, se vuelve cada vez más elástico hasta que llega a la temperatura de transición vítrea, Tg, se convierte en un sólido duro, rígido y frágil. Lo que sucede es que, conforme disminuye la temperatura, el polímero se contrae porque las cadenas se mueven menos y se atraen más. Dado que va disminuyendo el volumen libre, es decir, los espacios entre las moléculas, los segmentos de las cadenas tienen cada vez menos lugar para girar, hasta que al llegar a Tg, dejan de hacerlo, el material se pone rígido y en esas condiciones se vuelve vítreo, es decir frágil, porque como sus cadenas aunque todavía vibran ya no pueden girar para cambiar su posición, y no tienen manera de amortiguar los impactos. A esta restricción del movimiento molecular también contribuye por supuesto, la falta de suficiente energía debida a las bajas temperaturas.
Evidentemente, el estado vítreo lo alcanzan diferentes polímeros a diferentes temperaturas. Los que sean más flexibles, con menos grupos voluminosos o con eteroátomos en sus cadenas, podrán girar o permanecer flexibles a temperaturas menores que los otros. Por ejemplo, los silicones, el polietileno y el hule natural tienen temperaturas de transición vítrea de -123, -120 y -73 °C respectivamente. En cambio, polímeros con grupos grandes o grupos muy polares o polarizables, tienen de por sí tan baja movilidad que son vítreos a temperatura ambiente y para reblandecerlos se requiere de altas temperaturas.
La línea ABEF se refiere al polímero semicristalino. En este caso existen dos transiciones: una, cuando cristaliza el polímero al enfriarlo (Tm) y la otra cuando el material elástico resultante se vuelve vítreo (Tg).
Entre Tm y Tg, los cristalitos están embebidos en una matriz más o menos elástica y el material es correoso, pero abajo de Tg los cristales están dispersos en una matriz frágil.
Las propiedades mecánicas de los polímeros también cambian con la temperatura y en la gráfica del módulo de elasticidad con la temperatura se aprecian las mismas transiciones.
Abajo de Tg, el material es un sólido vítreo de gran rigidez, que se manifiesta por altos módulos que generalmente alcanzan los 106 psi. la única deformación posible se debe al estiramiento y doblamiento de los enlaces covalentes que unen a los átomos en la cadena, y al estiramiento de los enlaces intermoleculares. Esta deformación no es permanente ni puede ser muy pronunciada.
A temperaturas superiores a Tg, la deformación es más extensa y más dependiente del tiempo, porque las moléculas ya tienen mayor libertad y cambian continuamente su forma y hasta cierto punto su posición. La aplicación del esfuerza tiende a orientar a las moléculas en favor de configuraciones que tiendan a hacer trabajo. Por ejemplo, un esfuerzo de tensión extiende a las moléculas y las orienta en la dirección del esfuerzo aplicado porque así se produce una elongación de la muestra.
Si la temperatura es mayor, pero muy cercana a Tg, la deformación es prácticamente reversible y se debe al reordenamiento de segmentos cortos de las cadenas.
Entre Tg y Tm, el material es huloso porque las cadenas están enmarañadas y eso dificulta su movimiento.
A temperaturas cercanas a Tm y mayores, las cadenas poliméricas ya se deslizan y separan causando flujo viscoso irreversible. El material se comporta como un líquido muy viscoso.
Un polímero parcialmente cristalino, generalmente tiene mayor resistencia mecánica que el mismo material con estructura amorfa. La mayor resistencia o mayor módulo se debe al gran número y espaciamiento regular de los espacios intermoleculares en las estructuras cristalinas. En los polímeros amorfos, el número de estas interacciones es menos y su espaciamiento es errático, así que al aplicarles esfuerzos, muchas secciones del polímero se extienden o deforman libremente.
Factores cinéticos que controlan la cristalización.
La velocidad de cristalización de los polímeros depende de factores cinético que afectan la capacidad de los segmentos de cadena, para acomodarse en sus posiciones dentro de la red cristalina.
Esos factores son:
1. Flexibilidad de las moléculas.
2. Condiciones de la cristalización.
1. Flexibilidad de las moléculas.
Para que un polímero cristalice, sus moléculas deben tener suficiente elasticidad, es decir, la movilidad necesaria para colocarse en posiciones precisas durante el proceso de cristalización.
Uno de los polímeros con cadenas más flexibles es el polietileno, cuyos segmentos giran fácilmente y eso explica la gran tendencia a cristalizar.
Para apreciar esto, usaremos una proyección en la que imaginamos ver un segmento de dos carbonos, a lo largo del eje mayor de la cadena
Cuando los átomos de carbono giran, llegan a quedar eclipsados y en esa posición, la repulsión entre ellos es máxima.
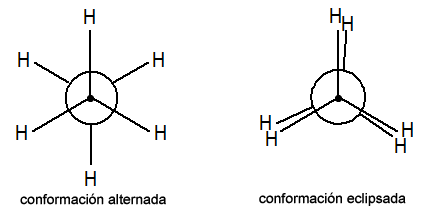
Cuanto mayor es el tamaño de los átomos o grupos químicos y mayor es su polaridad, más fuerte es la repulsión, más se dificulta el giro y menos flexible es la molécula.
En el polietileno todos los sustituyentes son átomos de hidrógenos y aunque desde luego se repelen, su tamaño es pequeño y las moléculas de polietileno son bastante flexibles, lo cual le permite cristalizar con facilidad, especialmente cuando no tienen ramificaciones, como en el caso del polietileno d alta densidad.
En cambio, en el policloruro de vinilo, uno de los sustituyentes es cloro, átomo de gran tamaño y alta polaridad. La resistencia al giro de los segmentos es muy grande, y el PVC es un polímero rígido con grado de cristalinidad que rara vez sobrepasa el 20 %.
Estructuras químicas que influyen sobre las cadenas polímeras.
- Enlaces dobles;
- Grupos aromáticos;
- Heteroátomos en el esqueleto;
- Grupos alquílicos.
a) Enlaces dobles. Los enlaces unidos por la doble ligadura no pueden girar, pero en cambio los segmentos de cadena que le siguen gozan de gran movilidad, precisamente porque los carbonos del doble enlace tienen un sustituyente menos, que si se trata de enlaces sencillos.
Esto explica la gran flexibilidad de los hules de isopreno o del butadieno, que tienen dobles enlaces en sus cadenas.
La presencia de enlaces dobles conjugados imparte rigidez a las moléculas de los polímeros, como le ocurre al PVC cuando se degrada por pérdida de ácido clorhídrico; El PVC degradado es más rígido.
b) Grupos aromáticos. Los anillos bencénicos producen rigidez en las moléculas y a veces evitan la cristalización y en otros casos la reducen.
El polietileno atáctico, por ejemplo es completamente amorfo.
Esto no necesariamente es un defecto. Cuando se desea transparencia en un polímero, se selecciona uno amorfo, y el poliestireno tiene precisamente esta cualidad.
Cuando los grupos aromáticos forman parte del esqueleto, en vez de estar colgando de él, y cuando su colocación es simétrica, el material puede tener alta cristalinidad, a lo cual ayuda una elevada polaridad, como en el caso del polietilentereftalato.
Las cualidades de alta polaridad y alta cristalinidad (cohesividad), son esenciales para que un polímero forme buenas fibras. Sólo así tendrá la resistencia tensil que se requiere.
3) Heteroátomos en el esqueleto. Heteroátomos son los átomos que no son de carbono. Por ejemplo, en el caso de que en la cadena central halla átomos de azufre o de oxígeno.
— CH2— O— CH2— — CH2— S— S— CH2—
Las cadenas son muy flexibles, porque los heteroátomos no tienen sustituyentes que obstaculicen el giro de los segmentos que le siguen.
El enlace más flexible que se conoce, por lo menos de los que existen en polímeros, es el de silicio — oxígeno.
— Si— O— Si— .
Por eso los silicones forman materiales tan flexibles y retienen esa flexibilidad a temperaturas hasta 100 °C bajo cero.
d) Grupos alquilos. Los grupos metílicos del propileno, estorban mucho para el giro de los segmentos y obligan a la molécula a tomar una forma helicoidal, en la que se minimizan las interacciones de estos grupos metilos con otros átomos de la molécula de polipropileno.
Sin embargo, esto no impide la cristalización del polipropileno cuando de trata del isotáctico o del sindotáctico. La consecuencia es una densidad muy baja (0,91) por el espacio libre que queda dentro de la hélice.
Si los grupos alquílicos son de mayor tamaño, las moléculas adyacentes se separan, dejando entre ellas mayor volumen libre y los polímeros se vuelven más flexibles, con menor temperatura de fusión y bajas densidades.
Pero cuando esas cadenas laterales alcanzan longitudes considerables, con 10 a 12 átomos de carbono, y no tienen ramificaciones, vuelve a ser posible la cristalización por el ordenamiento de esas cadenas laterales, ya sea dentro de la propia molécula o entre moléculas adyacentes.
2. Condiciones de la recristalización.
El efecto de la temperatura sobre la cristalización de los polímeros es conflictivo. Por una parte, se requieren temperaturas altas para impartir a las moléculas poliméricas suficiente energía cinética (movilidad) y que puedan acomodarse en la red cristalina. Pero sólo a bajas temperaturas van a permanecer en forma estable en los cristales.
El balance entre esas dos condiciones produce una velocidad máxima de cristalización a una temperatura intermedia.
Factores que determinan el grado de cristalinidad.
Influencia de la cristalinidad sobre las propiedades.
Existen dos factores estructurales que favorecen la cristalización en los polímeros.
- La regularidad de la estructura molecular hace posible que las moléculas se acomoden en una red cristalina.
- La polaridad de las moléculas aumenta la atracción entre cadenas adyacentes y, en consecuencia, la atracción que tiende a colocarlas ordenadamente en el cristal y mantenerlas firmemente en él.
1) Regularidad estructural.
a) Simetría: la presencia de anillos de fenileno en una cadena puede dar origen a tres distintas estructuras.
De ellas, la primera es la de mayor simetría y representa un polímero más cristalino que los otros.
b) Número par vs. Número non de átomos de carbono entre grupos funcionales: en el caso de las poliamidas y de los poliésteres, cristalizan mejor los materiales con número par de carbonos entre grupos amídicos o grupos éster respectivamente y cuanto mayor es la cristalinidad, más alto es el punto de fusión.
Cuando el número es par, las cadenas son asimétricas
c) Tacticidad: los polímeros isotácticos y los sindiotácticos tienen regularidad estructural y son cristalinos, mientras que los atácticos son amorfos.
Los polímeros isotácticos y los sindiotácticos tienen mayor cristalinidad, mayor resistencia mecánica, mayor densidad, más alta temperatura de fusión, son más resistentes a la acción de los disolventes, y poseen menor transparencia, en comparación con los mismos materiales en la variedad atáctica.
d) Configuración CIS vs. TRANS: existen dos tipos de hule natural que provienen del isopreno.
Hay dos configuraciones posibles.
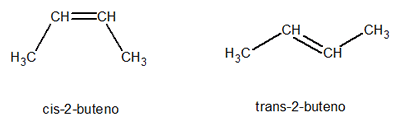
La primera se llama configuración CIS y así es el hule de la hevea y el de Guayule que se caracterizan por su flexibilidad y su elasticidad, la cual deben en parte a su estructura CIS, que es irregular y les impide cristalizar.
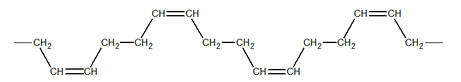
En cambio, la configuración TRANS, con gran regularidad estructural, está presente en el hule de gutapercha, que es cristalino, mucho menos elástico, con alta dureza, por lo que se lo emplea como cubierta de pelotas de golf.
![]()
e) Ramificaciones: El ejemplo más claro de las ramificaciones sobre el grado de cristalinidad es el polietileno, del cual hay básicamente tres variedades, las cuales se muestran en el cuadro siguiente.
| Polietileno |
Cristalinidad % |
Densidad gramos/cm3 |
Punto de fusión °C |
| Alta densidad | 80 — 95 |
0,94 a 0,97 |
hasta 135 |
| Baja densidad | 50 — 75 |
0,91 a 0,93 |
105 — 110 |
|
Lineal de baja densidad |
70 — 90 |
0,92 — 0,95 |
110 — 125 |
El polietileno de alta densidad, se fabrica a presiones bajas, utilizando los catalizadores de Ziegler— Natta o los de óxido de cromo o de molibdeno apoyados en óxidos de aluminio.
El polietileno de baja densidad se obtiene por radicales a presiones muy altas: 1.5000 a 3.000 atmósferas. Tanto éste como el de alta densidad, son homopolímeros del etileno y la diferencia entre ellos es la cantidad y el tipo de ramificaciones.
El polietileno de alta densidad, fabricado por los catalizadores de Ziegler— Natta, tiene pocas cadenas laterales de dos carbonos y el que se hace con los catalizadores a base de óxidos metálicos es prácticamente lineal, y es el de mayor densidad.
En cambio, el polietileno de baja densidad tiene muchas ramificaciones: 25 a 30 grupos CH3 por cada 1.000 carbonos, varias cadenas de de C4 y algunas de mayor tamaño.
Estas ramificaciones dificultan la aproximación de las cadenas y su colocación ordenada, disminuyendo el grado de cristalinidad, dejando grandes espacios entre las cadenas y por ello el material tiene mayor densidad. Por lo mismo, las fuerzas de atracción entre cadenas adyacentes no pueden actuar plenamente y, al ser menor la fuerza de cohesión, el calor separa con mayor facilidad las cadenas y el polímero se reblandece a menor temperatura, tiene menor rigidez, mejor resistencia al impacto y mayor transparencia y flexibilidad que el de alta densidad.
El polietileno lineal de baja densidad se separa por copolimerización del etileno CH2=CH2 con a olefinas, empleando catalizadores de Ziegler— Natta o los catalizadores de óxido de cromo a temperaturas y presiones moderadas.
Las a olefinas más empleadas son:
- Propileno;
- 1 buteno;
- 4 metil 1 penteno;
- 1 octeno.
El polietileno lineal de baja densidad tiene ramificaciones del mismo tamaño y esto le imparte suficiente regularidad estructural para un grado de cristalinidad bastante alto, pero con baja densidad.
La ventaja del polietileno lineal sobre el ramificado de igual densidad es su mayor rigidez, que permite hacer películas más delgadas con propiedades mecánicas comparables. El ahorro en material compensa el mayor del polietileno lineal de baja densidad.
f) El peso molecular: Los grupos químicos que se encuentran en los extremos de las cadenas, no son iguales que el resto de las unidades estructurales y le restan regularidad a la estructura.
También tienen mayor movilidad, puesto que están unidos a la cadena de un solo lado.
Estos dos factores interfieren en la cristalización. Como los polímeros de bajo peso molecular tienen una alta concentración de extremos, también tienen, en general, una baja cristalinidad.
Por otra parte, los polímeros de muy alto peso molecular tienen dificultad para cristalizar, debido a que las cadenas muy largas se enmarañan más.
La consecuencia de todo esto es que para cada polímero, hay un intervalo intermedio de pesos moleculares en que el grado de cristalinidad es máxima.
g) Copolimerización: La copolimerización por lo general destruye la regularidad estructural y baja el grado de cristalinidad a lo menos de que se trate de copolímeros alternados.
La copolimerización se usa industrialmente para reducir la temperatura de fusión de poliésteres y poliamidas que se usan en adhesivos de fusión en caliente (hot melts.).
Otro caso es el de cloruro de vinilo — acetato de vinilo, un copolímero mucho más flexible que el PVC, y que se emplea para hacer discos fonográficos.
h) Plastificantes: Los plastificantes son sustancias que se agregan a los polímeros para impartirles mayor flexibilidad. Los más comunes son los ftalatos como el DOP.
Si se incorpora un plastificante a un polímero cristalino, se reduce la cristalinidad, se vuelve más flexible y se reblandece a menor temperatura.
El plastificante actúa como un separador de las cadenas.
2. Polaridad.
Ya hemos visto que se requiere regularidad estructural para que haya cristalinidad en los polímeros. A demás si las fuerzas polares entre átomos y grupos químicos en moléculas adyacentes son suficientemente altas, las fuerzas que favorecen la ordenación serán mayores y los cristales retendrán su identidad a mayores temperaturas. En consecuencia, la temperatura de fusión está relacionada con la polaridad de los polímeros, como se aprecia en la siguiente serie de polímeros cristalinos de polaridad creciente.
| Polímeros | Temperatura de fusión °C |
| Polietileno alta densidad | 135 |
| Polimetilmetacrilato isotáctico | 160 |
|
policloruro de vinilideno |
198 |
| Nylon 66 | 265 |
| Politetrafluoruro etileno (teflón) | 327 |
La solubilidad de los polímeros, es decir, su interacción con disolventes de varios tipos, es la forma más común de evaluar la polaridad de las moléculas poliméricas.
Cuando se trata de moléculas pequeñas puede medirse la densidad de energía cohesiva (DEC) de los líquidos, en esta forma:
DEC = Calor molar de vaporización Volumen de un mol de líquido.
Esta cantidad depende de la magnitud de las fuerzas de atracción intermoleculares, que se oponen a la vaporización.
En el caso de los polímeros, la densidad de energía cohesiva se mide indirectamente, puesto que no se les puede vaporizar. Se aprovecha la circunstancia de que los líquidos sólo disuelven substancias con polaridad muy similar a la de ellos.
La raíz cuadrada de la densidad de energía cohesiva, es el parámetro de solubilidad d :
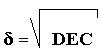
Este parámetro expresa la afinidad entre la sustancias y solamente hay solubilización si las d de ellas tienen valores que no difieren más de una o dos unidades.
Un valor alto del parámetro de solubilidad indica una alta polaridad. Los datos de las tablas que se muestran a continuación, a demás de indicar la polaridad de las diferentes sustancias, sirven para saber cuáles líquidos pueden usarse para disolver cada polímero.
| Disolvente | δ |
|---|---|
| n-Hexano (éter de petroleo) | 7.3 |
| éter dietílico | 7.4 |
| n-octano | 7.6 |
| metil-ciclohexano | 7.8 |
| di-isopropil-cetona | 8.0 |
| aguarrás (α y β pineno) | 8.1 |
| ciclohexano | 8.2 |
| metil-isobutil-cetona | 8.4 |
| dipenteno | 8.5 |
| tetracloruro de carbono | 8.6 |
| piperidina | 8.7 |
| xileno | 8.8 |
| tolueno | 8.9 |
| 1,2-dicloropropano | 9.0 |
| acetato de etilo | 9.1 |
| benceno | 9.2 |
| cloroformo | 9.3 |
| tetracloroetano | 9.4 |
| tetralina | 9.5 |
| carbitol | 9.6 |
| cloruro de metileno | 9.7 |
| dicloro etileno | 9.8 |
| ciclohexanona | 9.9 |
| dioxano | 9.9 |
| acetona | 10.0 |
| Piridina | 10.9 |
| Nitroetano | 11.1 |
| n-butanol | 11.4 |
| Isopropanol | 11.5 |
| n-propanol | 11.9 |
| Dimetlformaldehida | 12.1 |
| Ácido acético glacial | 12.6 |
| Etanol | 12.7 |
| Cresol | 13.3 |
| Ácido fórmico | 13.5 |
| Metanol | 14.5 |
| Glicerol | 16.5 |
| Agua | 23.4 |
| Polímero | δ |
|---|---|
| Polietileno | 7.9 a 8.1 |
| Polipropileno | 7.9 |
| Hule estireno-butadieno (25% E) | 8.1 a 8.54 |
| Poli-isopreno (hule natural) | 7.9 a 8.35 |
| Polibutadieno | 8.4 a 8.4 |
| Poliestireno | 8.5 a 9.7 |
| Policloropreno (neopreno) | 9.2 a 9.4 |
| Hule nitrilo (25% acrilonitrilo) | 9.2 a 9.5 |
| Acetato de polivinilo | 9.4 |
| Polimetilmetacrilato | 9.0 a 9.5 |
| Policloruro de vinilo (PVC) | 9.4 a 9.7 |
| Policarbonato | 9.5 |
| Policloruro de vinilideno | 9.8 |
| Polietilentereftalato | 10.7 |
| Acetato de celulosa | 11.35 |
| Resinas epóxidas | 11.0 |
| Nylon 66 | 13.6 |
| Poliacrilonitrilo | 15.4 |