Clasificación
Se denominan combustibles gaseosos a los hidrocarburos naturales y a los fabricados exclusivamente para su empleo como combustibles, y a aquellos que se obtienen como subproducto en ciertos procesos industriales y que se pueden aprovechar como combustibles.
La composición de éstos varía según la procedencia de los mismos, pero los componentes se pueden clasisificar en se pueden clasificar en gases combustibles (CO, H2, (HC)) y otros gases (N2, CO2, O2).
Los combustibles gaseosos se clasificacan en:
- Combustibles gaseosos naturales
- Combustibles gaseosos manufacturados
Nos interesa conocer el porcentaje de los componentes que integran los gases. Se usan para estos los mismos procedimientos que para el análisis de los gases de combustión.
Exste otra clasificación de los combustibles gaseosos que se refiere a su grado de intercambiabilidad. Esto nos permite clasificar los combustibles gaseosos en familias, que son 3: 1ª, 2ª, 3ª.
Propiedades y ventajas de los combustibles gaseosos
El poder calorífico, una de las propiedades más importantes de un combustible, se expresa para los combustibles gaseosos por unidad de volumen en condiciones normales. El valor del poder calorífico va a variar mucho dependiendo del tipo de gas que estemos manejando, y por lo tanto, en función de los componentes del combustible que estemos manejando. Los componentes no combustibles de un combustible van a bajar el rendimiento calorífico de la combustión. Sin embargo, a pesar de esto, a veces, un combustible de calidad inferior pero que sea subproducto de un proceso industrial puede ser más ventajoso económicamente.
Recordamos que existen dos clases de poder calorífico:
- Poder calorífico superior, que es el que se libera al realizar la combustión de una unidad de volumen de gas
- Poder calorífico inferior, que es igual que el anterior, pero sin tener en cuenta el calor de condensación del agua producida en la combustión.
Las unidades del poder calorífico son Kcal/m3; Btu/ft3; Cal/L
La unidad de volumen puede ser:
Nm3: En condiciones normales: Volumen medido a PN: 1 atm TN: 0ºC
Sm3: En condiciones estándar: Volumen medido a PS: 1 atm TS: 15’6ºC
Para expresar la energía liberada en una combustión se usa la TERMINA
TERMIA=2500 cal
Para calcular el poder calorífico de un combstible gaseoso hay que conocer la composición del mismo (porporción de componentes). Conociendo los calores de combustión de los componentes individuales resulta relativamente sencillo calcular el poder calorífico del combustible:
![]()
Otra propiedad importante del combustible es el calor específico. Se define éste como la cantidad de calor requerida para que la unidad de masa de gas aumente su temperatura 1ºC. Las unidades son cal/gºC; Kcal/KgºC; Btu/lbºF. Pero lo cierto es que al aumentar la temperatura existe una dilatación; es por ello que se definen los siguientes calores específicos:
- Calor espefícico a volumen constante (Cv)
- Calor específico a presión constante (Cp)
Cv es menor que Cp, ya que hay que tener en cuenta el trabajo de expansión que hay que realizar. Hay una relación entre estos dos valores:
Cp/Cv
Gas
monoatómico: 1,67
Gas
diatómico: 1,40
Gas
triatómico: 1,33
Otra propiedad de los combustibles gaseosos es la viscosidad. Al aumentar la temperatura aumenta la viscosidad. Existen dos tipos de viscosidades, la cinemática y la dinámica.
Otra propiedad de los combustibles gaseosos es el índice de Wabbe (W). También está el índice de Wabbe corregido, que se define como la relación entre el PCS y la raíz de la densidad relativa:
![]()
El índice de Wabbe corregido tiene en cuenta los hidrocarburos más pesados que el CH4, CO2 y otros:
Wc = K1·K2·W
K1 y K2 depende de la familia del combustible y del contenido en CO2, CO y O2. También el efecto de hidrocarburos más pesados que el metano
Una característica útil de los combustibles gasesoso es el denominado potencial de combustión, que se define del siguiente modo:
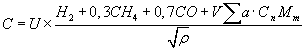
a: factor característico de la velocidad de la llama
Otra característica importante de los combustibles es su intercambiabilidad. Se dice que dos gases son intercambiables cuando distribuidos bajo la misma presión en la misma red y sin cambios de regulación producen los mismos resultados de combustión (el mismo flujo calorífico) y la llama presenta la misma e idéntica posición y el mismo comportamiento también.
Es imposible en la realidad que dos gases sean intercambiables al 100%; lo que se mira realmente es que prácticamente sean intercambiables. Existen unos diagramas de intercambiabilidad en los que de un modo rápido se puede ver si un gas es intercambiable con otro (diagramas de Delbourg)
3.- COMBUSTIÓN DE UN COMBUSTIBLE GASEOSO
En la combustión de un combustible gaseoso es fácil deducir que la mezcla con el comburente se realiza de una manera fácil. El modo en que básicamente se realiza la combustión es igual que para un combustible sólido o líquido. Se sigue utilizando, en general, el aire como comburente, aunque a veces se usa el oxígeno. Es necesario en este caso el uso de quemadores, que es donde se va a producir la mezcla combustible comburente. La combustión es rápida, pero no instantánea. Es necesario un tiempo de mezcla para facilitar la reacción.
La combustión es, como sabemos, una reacción de oxidación. La llama es la fuente de calor de esta reacción. En todo proceso de combustión hay 3 condiciones que se deben cumplir:
1) Para que puede iniciarse y propagarse la combustión, hace falta que simultáneamente el combustible y el comburente esté mezclado en cierta proporción y que la temperatura de la mezcla sea localmente superior a la temperatura de inflamación
2) Para que la combustión se mantenga debe ocurrir que
- Los productos originados en la combustión de evacúen a medida que se producen
- La alimentación del comburente y del combustible sea tal que se cumplan las condiciones expuestas hasta ahora (1)
3) Para que la combustión se realice en buenas condiciones se debe cumplir que:
- El aire
empleado en la combustión sea el correspondiente a una combustión completa sin
exceso de aire
aire empleado = aire mínimo - Debe haber una determinada turbulencia y un tiempo determinado
Características de la combustión de gases
- Temperatura de ignición: La temperatura de ignición es la mínima temperatura a la que puede iniciarse y propagarse la combustión en un punto de una mezvla aire gas. El autoencendido de una mezcla aire gas se produce sobre los 650-700ºC.
- Límites de inflamabilidad: Se entienden estos como los porcentajes de aire y gas que presentan una mezcla de ambos para que pueda iniciarse y propagarse la combustión de dicha mezcla. Normalmente se expresa en porcentaje de gas combustible en la mezcla. Tanto el exceso se combustible como de comburentes son perjudiciales para la combustión, fuera de los límites de inflamabilidad
- Velocidad de deflagración: Es la velocidad de propagación de una llama estable
Parámetros interesantes en la combustión de gases:
Poder comburívoro o aire teórico: Es la cantidad de aire necesaria para asegurar la combustión de 1 m3 de gas. Suele expresarse en m3 normal de aire/m3 normal de gas
Poder fumígeno (humos o gases de combustión): Conjunto de productos en estado gas que se obtienen en el proceso de combustión. Se trata del volumen expresado en C/N de los gases de combustión que se obtienen en la combustión completa de 1 Nm3 de gas asociado a una cantidad de aire igual a la teórica. Se pueden distinguir:
- Humos secos: No se considera el vapor de agua
- Humos húmedos: Se considera el vapor de agua
Se expresan en Nm2 humos/Nm3 normal de gas
Índice de exceso de aire: Una combustión con el aire teórico es imposible, por lo que es necesario en la práctica un exceso de aire, que se regula por un coeficiente de suministro (que es el índice de exceso de aire o algo parecido). Pude darse una combustión incompleta, con inquemados gaseosos siempre (nunca podrán aparecer inquemado sólidos).
Temperatura teórica de combustión: Aquella temperatura que alcanzarían los productos de combustión si todo el calor generado en la misma se pudiera emplear en su calentamiento. Esto es imposible por pérdidas de calor en la instalación. Enriqueciendo el contenido en oxígeno es posible aumentar la temperatura actual de combustión hasta un cierto límite.
El soporte físico de la combustión de los combustibles gasesosos son los quemadores. El quemador es el órgano destinado a producir la llama. Lo hace poniendo en contacto las cantidades necesarias de aire y de gas para que se realice la combustión. El quemador debe regular una serie de aspectos, como son:
- La mezcla aire-gas. Debe ser adecuada en todo momento
- Caudales de aire y de gas
- Estabilidad de la llama
- Dimensiones y forma de la llama. Esto lo hace para poder adecuar la llama al recinto de combustión.
- Poder de radiación de la llama en un momento determinado
Los quemadores se pueden clasificar por el número o por el tipo de combustible con que funcionan, o también por el modo de funcionamiento.
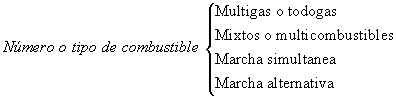

Número o tipo de combustible:
- Multigas: Funcionan con varios gases a la vez
- Mixtos: Pueden funcionar con distintos tipos de combustibles, pero no a la vez
- Marcha simultánea: Queman a la vez gas y otro tipo de combustibles (líquido o sólido)
- Marcha alternativa: Solo pueden quemar un tipo de combustible determinado
Modo de funcionamiento
- Atmosférica: Tienen llama corta, baja presión, el aire entra con ayuda de unos ventiladores
- De presión: Presión de hasta 3 atm
- Boca Radiante: La entrada de la mezcla se realiza a través de unas boquillas de un material refractario especial que se calienta hasta la incandescencia durante el funcionamiento, lo que facilita la combustión de los gases.
Cálculos de combustión
Los cálculos de combustión son análogos a los ya vistos. Los cálculos han de hacerse siempre en volumen. Si estamos quemando una mezcla se gases, cada uno tendrá una ecuación independiente.
Ventajas de los combustibles gaseosos
- Facilidad de manejo y transporte por tuberías
- No presentan cenizas ni materias extrañas
- El control de la combustión es mucho más fácil, lo que nos permite mantener la temperatura de combustión aún con demandas variables
- Posibilidad de regular la atmósfera de los hornos para conseguir atmósferas reductoras según nos convenga
- Posibilidad de calentar el gas en regenadores y recuperadores, elevando de esta manera la temperatura de combustión, y por lo tanto, aumentando el rendimiento térmico.
- Proceden o suelen proceder de combustibles sólidos de baja calidad, por lo que nos permite darle un uso mejor a dichos combustibles
- Es posible determinar su composición exacta, por lo que es posible determinar bastante bien su poder calorífico.
- A igualdad de calor cedido, la llama que origina un combustible gaseoso es más corta que la que origina un combustible sólido o uno líquido.
Gasificación de combustibles sólidos
La gasificación es la transformación de toda materia carbonosa en gas mediante la reacción del carbón incandescente con O2, vapor de agua, CO, SO2. Esto nos origina un conjunto de productos en estado gas cuya composición y propiedades dependen dependen de la naturaleza del agente gasificante que estemos utilizando en el proceso. El agente gasificante nos va a condicionar el uso del producto obtenido como gas combustible o como materia prima en otro porceso químico superior.
En principio todo los carbones son aptos para gasificar. Se suelen gasificar productos que no tengan empleo en coquerías. A nosotros nos interesan los procesos donde se obtenga gas combustible.
Gasificación con vapor de agua
De este modo obtenemos gas de agua o gas azul (este nombre es debido al color de la llama, azul, característico de la combustión del CO). La principal reacción que tiene lugar es:
C(S) + H2O + 30 Kcal ![]() CO + H2
CO + H2
Esta es una reacción endotérmica
El gas azul tiene un poder calorífico de 2580/2670 Kcal/m3 a PTS (presión y temperatura
estándar)
Esto representa un 60-80% del PCS del carbón.
El rendimiento de la gasificación se define como la relación entre el PC del gas y el PCS del carbón del cual procede, es decir:
![]()
El que se emplee el gas de agua como combustible es muchas veces más ventajoso que la combustión directa del carbón. Usando gas de agua se consigue:
- Mejorar la mezcla combustible/comburente; se mejora por lo tanto el control de la combustión, y además se logra que para que la combustión sea completa sea necesaria menos cantidad de aire adicional
- Se obtienen temperaturas más elevadas, porque el calor generado se aprovecha mucho mejor
- Podemos precalentar el combustible y el comburente a la vez
- No hay SO2 en la combustión
- No hay cenizas ni inquemados sólidos
Gasificación combinada de carbón y combustible líquido
Con este tipo de gasificación se obtiene el gas de agua carburado, de mayor rendimiento y poder calorífico. Se deriva del gas anterior, y aumenta su poder calorífico. Para obtener este tipo de combustible se ideó un dispositivo que mezclaba el carbón con un combustible líquido con los vapores del combustible líquido. Se utiliza el proceso denomina craqueo térmico (rotura de cadena por temperatura). De esta manera conseguimos mezclas de gas con mayor poder energético que el gas azul. El gas obtenido tiene un poder calorífico de 4000 cal/m3 e incluso superior. El combustible así obtenido suele ser del tipo ‘gasóleo’. Las cadenas carbonadas obtenidas son de 14-18 átomo de carbono. La proporción es
30 m3 de gas ![]() 9 litros de gasóleo
9 litros de gasóleo
Aplicaciones de la gasificación del carbón
Como combustible:
- Aplicaciones industriales: Se usa en calentamiento de hornos en procesos metalúrgicos. En la actualiad el CO empieza a decaer en su utilización en detrimento del fuel-óleo, del gas natural. Se siguen utilizando la gasificación del carbón en países y zonas con gran producción de carbón, como puede ser Sudáfrica, Australia, Países del Este,...
- Aplicaciones domésticas: Se usa para agua caliente, calefacción, cocinas. Se emplea sobre todo en países con grandes cuencas carboníferas.
Como materia prima en procesos de síntesis
- Se usa en la síntesis de amoníacos y gasolinas, éstas últimas de bajo octanaje