El formaldehído, HCHO, también conocido como formalina, formol, aldehído fórmico, metanal, es el primer miembro de las series de los adehídos alifáticos.
Es uno de los químicos orgánicos más importantes utilizado hoy en día en una gran cantidad de actividades y aplicaciones.
![]()
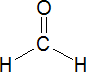
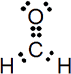
Ángulo
enlace OCH 121°
Ángulo enlace HCH 118°
El formaldehído fue preparado por primera vez por el químico ruso A.M. Butlerov en 1859 como el producto de una tentativa, al parecer poco afortunada, para sintetizar el glicol metilenico por hidrólisis del diacetato de metileno. Aunque Butlerov no supo que no había obtenido el formaldehído, su descripción de las propiedades físicas y químicas del compuesto, incluyendo el aislamiento del paraformaldehido y la síntesis de la hexametilenotetramina son indudablemente obra suya.
A.W. Hofmann sintetizó el formaldehído deliberadamente en 1868 por la reacción del metanol y el aire en presencia de un catalizador de platino (al poner en contacto una corriente de aire cargada de alcohol metílico con un espiral de platino incandescente).
En 1886 Loew inventó el método de obtención con catalizador de cobre, y en 1910 Blank patentó el procedimiento del catalizador de plata.
La producción industrial comenzó en Alemania en 1888 y en los EEUU en 1901. Sin embargo la producción se hizo solamente en escala limitada antes que aparecieran las resinas fenólicas comerciales en 1910. Desde hace varios años se fabrican cantidades crecientes de formaldehído por la oxidación del gas natural y de los hidrocarburos alifáticos inferiores.
A la temperatura ordinaria el formaldehído es un gas incoloro, inflamable, de olor muy irritante. Es soluble en el agua y los disolventes orgánicos usuales, pero insoluble en el éter de petróleo.
En la práctica, este compuesto se suministra bajo la forma de soluciones acuosas a concentraciones diversas (37-50% en peso). Son líquidos incoloros, de olor picante, miscibles con agua. Contienen alcohol metílico (hasta un 15 %) y trazas de ácido fórmico y ácido acético..
| Peso molecular | 30.03 |
| Punto de fusión | - 92ºC |
| Punto de ebullición (760 mm Hg) | -19.5 ºC |
| Densidad (20 ºC) | 1.09 (g/cm3) |
| Densidad de vapor | 1.075 |
| Tensión de vapor | |
|---|---|
| - 88 ºC | 10 mm |
| - 70.6 ºC | 40 mm |
| - 57.3 ºC | 100 mm |
| - 33 ºC | 400 mm |
| Límite de explosividad (%vol) en aire | |
| Límite inferior | 7 % |
| Límite superior | 73 % |
| Temperatura de auto ignición | 300 -430 ºC |
Puesto que el formaldehído puro es un gas a las temperaturas ordinarias y no puede manejarse fácilmente en ese estado, se comercializa principalmente en forma de solución acuosa (por lo general con 37% de HCHO en peso) y del polímero sólido hidratado, para-formaldehído (CH2O)n.H2O.
Propiedades del Formaldehído
Propiedades químicas del formaldehído
El formaldehído es un compuesto extremadamente reactivo. Se polimeriza muy fácilmente, incluso en frío, dando polímeros insolubles que enturbian las soluciones acuosas. Para evitar este inconveniente se les añaden estabilizantes, particularmente alcohol metílico.
Los oxidantes reaccionan enérgicamente con el formol. La mayoría de las reacciones de oxidación conducen a la formación de ácido fórmico, y la oxidación completa da lugar a anhídrido carbónico y agua.
A pesar de su fuerte reactividad, es un compuesto relativamente estable. El calor no lo descompone sensiblemente más que por encima de 300 ºC, con formación de óxido de carbono e hidrógeno. Esta descomposición está favorecida por ciertos catalizadores
Formaldehído anhídro
A las temperaturas ordinarias, el formaldehído puro es un gas incoloro que posee olor fuertemente picante y muy irritante para las mucosas de los ojos, nariz y garganta.
Podemos encontrarlo en estado gaseoso a presión atmosférica desde los –19,2ºC. Es un gas inflamable siendo su calor de combustión a 25ºC es de 561,5 KJ/mol y su temperatura de ignición 430ºC. Mezclado con el aire es explosivo, a 20ºC los límites entre los que el formaldehído mezclado con el aire explota son 7% y 72% en volumen.
Es incoloro, sofocante e irritante. Este gas se polimeriza a temperaturas ordinarias, en estado puro no se polimeriza entre los 80ºC y los 100ºC comportándose como un gas ideal.
El formaldehído gaseoso se disuelve fácilmente en agua, con la cual, reacciona para formar una mezcla en equilibrio del monohidrato disuelto, metanodiol, y una serie de hidratos polímeros de peso molecular bajo, que tienen una fórmula del tipo HO (CH2O)nH. El gas es fácilmente soluble en alcoholes, glicoles, amidas y otros disolventes polares, con lo que forma solvatos.
A temperaturas bajas se condensan en un líquido transparenta y móvil, que con el tiempo se convierte en un polímero sólido reversible: el polioximetileno. Cuando se calienta el líquido hasta la temperatura ordinaria en un tubo cerrado, se polimeriza rápidamente con producción de 15 Kcal/mol.
Se lo encuentra en estado líquido entre los –118ºC y los –20ºC. A menores temperaturas se solidifica formando una pasta blanca.
Es menos denso que el agua (0,8153 gr/cm3 a –20ºC y 0,9172 gr/cm3 a –80ºC). También se polimeriza en este estado siendo este proceso afectado por la presencia de humedad y pequeñas cantidades de ácido fórmico.
A bajas temperaturas es miscible en cualquier proporción con solventes no polares como el tolueno, cloroformo, etc.
Los solventes polares como ciertos alcoholes, aminas o ácidos, catalizan la polimerización del formaldehído o reaccionan con el para formar glicoles y sus derivados.
El gas completamente anhídro en cierto modo estable a la presión atmosférica a temperaturas de 80/100 C; pero a temperaturas más bajas se polimeriza poco a poco. La polimerización es fuertemente acelerada por indicios de compuestos polares, como ácidos, álcalis y agua, A temperaturas de 400 C o más, se descompone químicamente con velocidad apreciable, en monóxido de carbono e hidrógeno.
En general, los solvatos del formaldehído son químicamente reversibles y la composición reacciona como una solución de formaldehído
Solución de formaldehído
Las propiedades del formaldehído acuoso dependen de que en el estado disuelto esté polimerizado e hidratado. Puesto que suele manejarse como solución la composición y las propiedades del sistema formaldehído-agua tiene especial importancia. Las investigaciones realizadas han demostrado que el formaldehído disuelto es esencialmente una mezcla en equilibrio. Sin embargo, el espectro de absorción ultravioleta indica que hay pequeñas cantidades del monómero no hidratado en algunas condiciones de temperatura y concentración.
Es estado de equilibrio depende de la concentración y temperatura. En concentraciones del 2% o menos el formaldehído está prácticamente de glicol metilénico, en concentraciones mayores, la solución contiene proporciones crecientes de polímeros hidratados, y aumenta el grado de polimerización al aumentar la concentración del formaldehído disuelto.
La rapidez con que se alcanza el equilibrio, después de un cambio de temperatura o concentración, es pequeña a temperaturas bajas y exige más de dos días a 0C .
Las soluciones concentradas (más de 30% de HCHO) tienen que conservarse calientes si se quiere evitar la precipitación. Los alcoholes, como el metanol aumentan la estabilidad de la solución, por la formación de hemiacetales. La presión parcial del formaldehído en equilibrio con la solución es baja y es una función de la concentración del glicol de la concentración del glicol metilénico más que del contenido total del formaldehído.
Las moléculas de formaldehído están en un grado considerables asociadas al estado gaseoso y la presión parcial del gas puede considerarse cono la presión de descomposición del hidrato disuelto. Estos factores explican el hecho de que las soluciones de formaldehído pueden concentrarse por evaporación al vacío a temperatura baja, mientras que la destilación a presión y temperatura elevada hace posible obtener destilados concentrados partiendo de soluciones diluidas. Por destilación a presiones ordinarias sin rectificación, el residuo en el destilador está siempre algo más concentrado que la solución destilada. La condensación fraccionada de los vapores de solución en ebullición da como resultado un aumento de formaldehído en el vapor no condensado, ya que el agua es el componente menos volátil de la mezcla.
El formaldehído monomérico físicamente disuelto (CH2O) está solo presente en soluciones acuosas a concentraciones de hasta el 0,1% en peso.
Las soluciones de formaldehído en agua contienen formaldehído en la forma de glicoles (Oligómeros del metilenglicol) de acuerdo a la siguiente reacción de polimerización:
HOCH2OH + n CH2O ![]() HO(CH2O)n+1H
HO(CH2O)n+1H
Metilenglicol + Formaldehído ![]() Oligómeros
del metilenglicol
Oligómeros
del metilenglicol
Si la solución se encuentra a temperatura y presión ambiente, dentro de los glicoles el metilenglicol (HOCH2OH) es el que se en encuentra en mayor proporción (Nótese que el metilenglicol es una molécula de formaldehído a la que se le ha adicionado una molécula de agua) y los glicoles de mayor número de moléculas de formaldehído incorporadas se encuentran en menor proporción. El siguiente gráfico ilustra lo recién explicado.
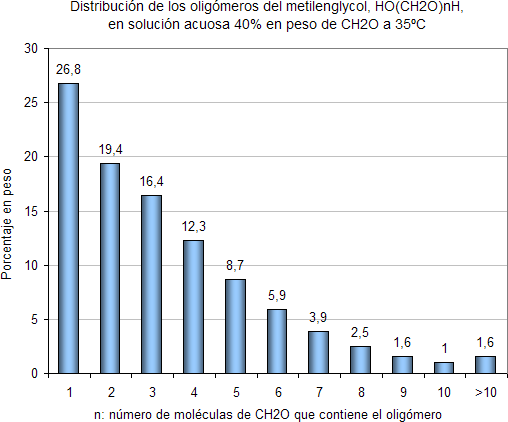
La barra a la cual le corresponde “ n = 1 “ indica que en una solución acuosa al 40% en peso de formaldehído a 35ºC , el 26,8% del peso de formaldehído agregado al agua se encuentra como metilenglicol, HOCH2OH.
La barra a la cual le corresponde “ n = 2 “ indica que en una solución acuosa al 40% en peso de formaldehído a 35ºC , el 19,4% del peso de formaldehído agregado al agua se encuentra como HO(CH2O)2H.