Drago propuso una serie de expresiones para calcular la ∆H de una reacción ácido-base en función de parámetros típicos de cada ácido y cada base. La primera ecuación fue la siguiente
A + B ![]() AB
AB
-∆H = EA EB +CA CB
donde ∆H es la entalpía de formación del aducto AB, EA y CA son parámetros característicos del ácido, y EB y CB de la base. Los parámetros E expresan la facilidad o dificultad de las especies para sufrir interacciones electrostáticas (polarización y formación de iones). Los parámetros C miden la tendencia a formar enlaces covalentes. Así, los ácidos que tienden a formar enlaces de tipo electrostático (EA grande) darán lugar a enlaces con bases que presenten la misma tendencia (EB grande), ya que el producto EAEB tendrá un alto valor. Sin embargo, los ácidos que formen enlaces covalentes lo harán con bases que también lo formen, y en este caso el factor CACB será elevado. Por ejemplo, véase la siguiente reacción:
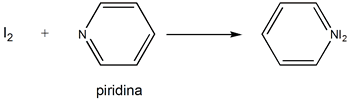
piridina = base
I2 = ácido
-∆H = EAEB + CACB
EA = 1.00; CA = 1.00 EB = 1.17; CB = 6.40
-∆Hcalc.= +7.57 kcal/mol = 31.7 kJ/mol
-∆Hexp.= +7.8 kcal/mol = 32.6 kJ/mol
Una ventaja de este método es que permite predecir a priori valores de entalpía de reacción para procesos que no se hayan estudiado aún experimentalmente. La siguiente tabla recoge valores de los parámetros E y C para distintas moléculas.
Parámetros E y CA
Ácidos |
E |
C |
|---|---|---|
| Iodo | 1.00 | 1.00 |
| SO2 | 0.92 | 0.81 |
| Fenol | 4.33 | 0.62 |
| ICl | 5.10 | 0.83 |
| alcohol hexafluoropropílico | 5.93 | 0.62 |
| SbCl5 | 7.38 | 5.13 |
| BF3 | 9.88 | 1.62 |
Bases |
||
| Piridina | 1.17 | 6.40 |
| Trimetilamina | 0.81 | 11.54 |
| Amoniaco | 1.36 | 3.46 |
| Trimetilfosfina | 0.84 | 6.55 |
El producto de los parámetros en kcal/mol.
A continuación se aplica ecuación de Drago a otro ejemplo:
Me3N + SO2![]() Me3NSO2
Me3NSO2
EA = 0.92; CA = 0.81
EB= 0.81; CB = 11.54
-∆H = (0.92x0.81) + (0.81x11.54) = 0.754 + 9.3474 = 10.1 kcal/mol = 42.22 kJ/mol
-∆Hexp= 40.2 kJ/mol
Si una de las especies que reaccionan, o las dos, es un ion, la formación del aducto se efectúa con una considerable transferencia de densidad de carga desde la especie negativa a la positiva. Esta transferencia de densidad de carga vendrá acompañada de una liberación de energía relacionada con las energías de ionización y afinidad electrónica. Con el objeto de soslayar estos problemas Drago modificó su ecuación de la siguiente forma:
-∆H= EAEB + CACB + W
donde W = RATB, y RA es la receptancia del ácido y TB es la transmitancia de la base. W adquiere un valor alto cuando la transferencia de carga es elevada. Por ejemplo,
H2O + H+![]() H3O+
H3O+
-∆Hexp = 695 kJ/mol (166 kcal/mol)
-∆Hcalc. = EAEB (102.6)+ CACB (1.3)+ W (56.0) = 159.9 kcal/mol= 668.4 kJ/mol
Ácidos y Bases Duros y Blandos.
Cuando se consideran ácidos más generales que los de Brönsted, se encuentra que en muchos casos (entre ellos el Al3+, el Cr3+ y el BF3) hay una correlación excelente entre el orden de afinidad hacia las bases y el obtenido cuando se usa el H+ como ácido. Sin embargo, dicha correlación no es posible encontrarla para ácidos como el Hg2+.
Para tratar las interacciones de los ácidos y bases que contienen a distintos elementos de toda la Tabla Periódica, es necesario considerar dos clases de sustancias: los ácidos y bases duros y blandos. Esta clasificación fue dada por R. G. Pearson, y consiste en una generalización de una distinción anterior entre los dos tipos de comportamiento que originalmente se denominaban sustancias de clase a y de clase b, respectivamente (clasificación introducida por Arland, Chatt y Davies). La distinción entre a y b era empírica y derivaba de la medición de la constante de equilibrio de formación de complejos con los iones haluro, Kf:
Mn+ + nX-![]() MXn
MXn
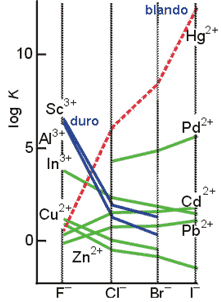
Variaciones de la constantes de equlibrio y clasificación de los cationes como duros, blandos e intermedios
Para una sustancia de clase a la Kf varía de la manera siguiente: F-> Cl-> Br-> I-; mientras que para las de la clase b lo hace de la siguiente forma: I-> Br-> Cl-> F-. Con esta idea en mente, para el caso del Hg2+ se observa que la constante aumenta bruscamente desde el F¯ hasta el I¯, lo que indica que es un ion de la clase b. En la clasificación de Pearson el Hg2+ representa un ejemplo de ácido blando. Para el Pb2+ esta variación es menos acentuada, pero sigue el mismo sentido: se trata, por tanto, de un ácido blando intermedio. El caso contrario es el del Zn2+, para el cual la variación se da en sentido contrario, tratándose de una ácido duro intermedio. La brusca variación en sentido contrario al del Hg2+, en el caso del Al3+, indica que se trata de un ácido duro. Como se observa, los ácidos y bases de Lewis se pueden ordenar como ácidos duros, blandos o intermedios. Generalmente, los ácidos duros son cationes pequeños, poco polarizables, y los blandos son cationes de los elementos de la parte derecha de la serie de transición. Las bases duras son también poco polarizables, mientras que las bases blandas presentan mayor polarizabilidad.
Los ácidos duros tienden a unirse a bases duras, mientras que los blandos tienden a enlazarse con las bases blandas. El enlace entre ácidos y bases duros se puede describir sobre la base de interacciones iónicas. Los ácidos y bases blandos son más polarizables que los duros y su enlace es más covalente. La dureza y blandura de una sustancia se puede interpretar en términos de los orbitales frontera de una molécula o átomo. Los ácidos y bases monoatómicos duros son aquellos que tienen orbitales frontera de energía muy diferente. Una molécula será blanda cuando la separación entre los orbitales frontera (HOMO/LUMO) es pequeña. Cuando esto ocurre, un pequeño campo eléctrico aplicado hace que la distribución electrónica pueda variar. Si la diferencia de energía es grande la nube de electrones se resiste a ser distorsionada y la molécula es dura. Un ácido duro no posee un LUMO de baja energía. Una base dura tiene un HOMO de baja energía (orbital fuertemente enlazante). Como las estructuras electrónicas no se pueden apenas perturbar su interacción es fundamentalmente electrostática. Por el contrario, el LUMO y el HOMO de un par blando se reorganizan para dar lugar a un enlace covalente.
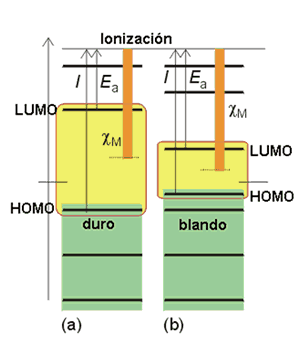
Dureza en términos de orbitales frontera.
La Tabla 3 muestra una clasificación de los ácidos y bases de Lewis en función de su dureza:
Clasificación de los ácidos y las bases de Lewis.
Duros |
Intermedios |
Blandos |
|
|---|---|---|---|
| Ácidos | H+, Li+, Na+, K+, Be2+, Mg2+, Ca2+, Cr2+, Cr3+, Al3+, SO3, BF3 | Fe2+, Co2+, Ni 2+ Cu2+, Zn2+, Pb2+, SO2, BBr3 | Cu+, Ag+, Au+, Tl+, Hg+, Pd2+, Cd2+, Pt2+, Hg2+, BH3 |
| Bases | F-, OH-, H2O, NH3 CO32-, NO3-, O2- SO42-, PO42-, ClO4- | NO2-, SO32-, Br- N3-, N2 C6H5N, SCN- | H-, R-, CN-, CO, I- SCN-, R3P, C6H6 R2S |