La esfera de coordinación primaria en un complejo está formada por los ligandos que se encuentran directamente unidos al centro metálico. El número de ligandos de la esfera de coordinación primaria se conoce como número de coordinación. A diferencia de los sólidos metálicos o iónico, los complejos de los metales de transición presentan números de coordinación menores. Los más frecuentes son 2, 4 ó 6. Los factores que determinan el número de coordinación en un complejo son tres:
- El tamaño del átomo central o ion.
- Las interacciones estéricas (de tamaño) entre los ligandos
- Las interacciones electrónicas (densidad de carga eléctrica transferida desde los ligandos al metal)
En general, el gran tamaño de los átomos o iones de los periodos 5 y 6 favorecen los números de coordinación mayores para estos elementos. Por las mismas razones, los ligandos muy voluminosos originan, por lo general, complejos con bajo número de coordinación. Altos números de coordinación son más comunes en la parte izquierda de las series de transición, donde los átomos presentan radios mayores y poseen pocos electrones en los orbitales d, de forma que el ion metálico es capaz de aceptar más electrones de las bases de Lewis. Los números de coordinación bajos se encuentran en complejos de metales de la parte derecha de las series d porque estos iones metálicos son muy ricos en electrones d.
Para determinar qué tipo de geometría adoptará un complejo no pueden aplicarse las reglas de RPECV discutidas en una lección anterior. La geometría que adopta un complejo va a venir determinada por su número de coordinación. Los ligandos se disponen en el espacio lo más alejados posibles unos de otros. En la tabla 1 se representan los números de coordinación más frecuentes y las geometrías más comunes que se presentan en los complejos.
Tabla 1. Geometrías según el número de coordinación.
Número de
coordinación |
Geometría |
|---|---|
2 |
Lineal |
4 |
Tetraédrica o Cuadrada
plana |
6 |
Octaédrica |
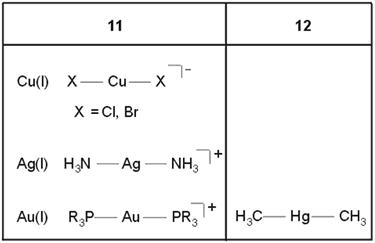
Los complejos más conocidos de bajo número de coordinación son complejos de geometría lineal formados por los iones de los grupos 11 y 12, Cu(I), Ag(I) y Hg(II) (Tabla 2).
Tabla 2. Complejos lineales (N.C. = 2)
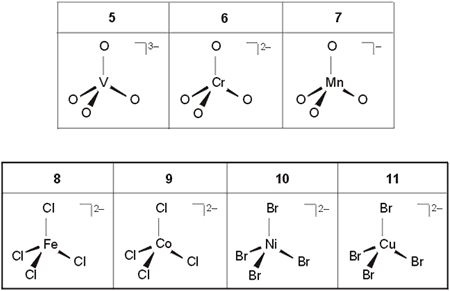
En contraste con lo anterior, el número de complejos que presentan un número de coordinación de cuatro es elevado. Cuando el átomo o ion central es pequeño y los ligandos son voluminosos, la geometría tetraédrica es la más favorecida. Los óxidos de los metales de la parte izquierda del bloque d, o los haluros de los metales de la parte derecha de la serie 3d son generalmente tetraédricos (Tabla 3).
Tabla 3. Ejemplos de complejos con N.C. = 4 (Tetraédrico)
Los complejos de número de coordinación cuatro y geometría plano-cuadrada estan formados por iones de configuración d8 (Pd(II), Pt(II), Rh(I), Ir(I), Au(III)) (Tabla 4):
El número de coordinación 6 es el más común para las configuraciones electrónicas desde d0 hasta d9. Por ejemplo, los complejos de los iones M3+ de la serie 3d son generalmente octaédricos: [Sc(OH)2]3+ (d0), [Cr(NH3)6]3+ (d3), [Mo(CO)6] (d6), [Fe(CN)6]3- y [RhCl6]3- (d6).
La gran mayoría de los complejos de número de coordinación seis son octaédricos. Sin embargo, sus geometrías no suelen ser octaedros perfectos (seis distancias M-L iguales y todos los ángulos de 90º) sino que sufren distorsiones.
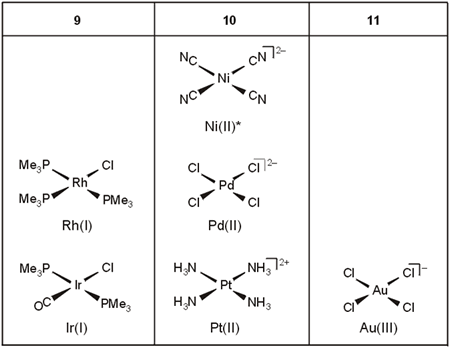
Tabla 4. Complejos plano-cuadrados.
Estas distorsiones, que aparecen en la Figura 3, son de tres tipos: tetragonal, rómbica y trigonal.
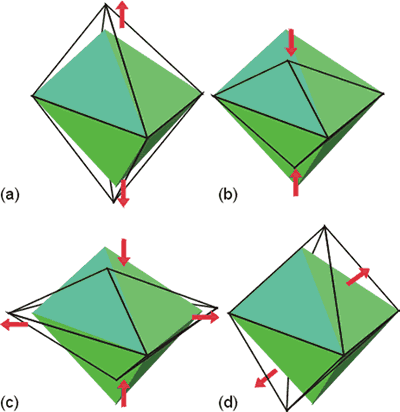
Figura 3. Distorsiones a partir de un tetraedro regular (a) y (b) tetragonal, (c) rómbica y (d) trigona