Los orbitales atómicos de las moléculas atómicas heteronucleares difieren de los de las homonucleares en que presentan una contribución desigual de cada uno de los orbitales atómicos que los constituyen. Cada orbital molecular, en este tipo de molécula, se puede representar como una combinación lineal de los orbitales atómicos:
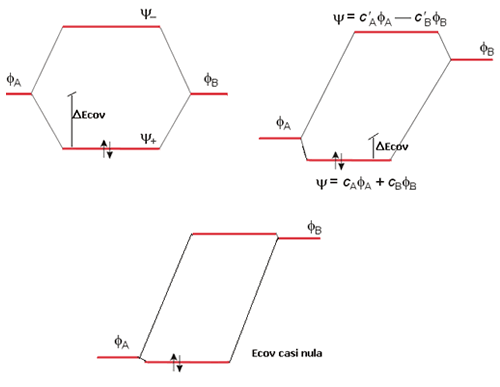
Ψ = cAφA + cφAφB
Pero, en contra de lo que sucede en las moléculas homonucleares, los coeficientes cA y cB no son iguales en magnitud. Si cA>cB, el orbital molecular Ψ estará compuesto principalmente por φA y los electrones que ocupen dicho orbital se encontrarán más próximos al átomo A que al B.
Comparación entre el Diagrama de Orbitales Moleculares para (a) Molécula Homonuclear (b) Molécula Heteronuclear y (c) enlace iónico.
La mayor contribución al orbital molecular enlazante normalmente proviene del átomo más electronegativo, debido a que la energía de estos orbitales es siempre menor que la de los orbitales del átomo más electropositivo. En consecuencia, los electrones del enlace se "encontrarán" cerca del átomo más electronegativo. El enlace en este tipo de moléculas será un enlace covalente polar, pues los electrones del enlace no son igualmente compartidos por ambos átomos. Obviamente si en el orbital molecular enlazante cA>cB, para el antienlazante debe cumplirse lo contrario, esto es, cB>cA, para que la contribución neta de ambos orbitales atómicos a los dos orbitales moleculares sea la misma.
Una segunda diferencia entre las moléculas diatómicas homo y heteronucleares es que la disminución en energía, como resultado del solapamiento de los orbitales atómicos de los diferentes átomos, en una molécula heteronuclear es mucho menos pronunciada que en una molécula homonuclear, en la cual los orbitales atómicos tienen la misma energía. A este efecto, recuérdese que la energía de estabilización es la diferencia entre el orbital atómico más bajo en energía que participa en el enlace y el orbital molecular enlazante. En el caso de una molécula homonuclear los dos orbitales atómicos son idénticos, pero no así en el caso de una heteronuclear. Sin embargo, esto no significa necesariamente que un enlace A-B sea más débil que uno A-A. Existen factores como el tamaño de los orbitales y la proximidad del acercamiento que son también importantes. La molécula de CO, por ejemplo, que es isoelectrónica con la molécula de N2, posee una entalpía de enlace de 1070 kJ mol-1, un valor mayor que la de la molécula de dinitrógeno (946 kJ mol-1). El caso extremo de un enlace covalente polar es el del enlace iónico, en el cual uno de los átomos tiene el control completo sobre el par de electrones del enlace.
La molécula de fluoruro de hidrógeno (HF).
Para ilustrar la discusión anterior considérese la molécula de HF. Los orbitales de valencia disponibles para la formación de los orbitales moleculares en esta molécula son, el orbital 1s del átomo de H y los orbitales 2s y 2p del átomo de F, en total 5 orbitales atómicos que se combinan para formar 5 orbitales moleculares. Hay 8 electrones de valencia para situar en los cinco orbitales moleculares resultantes. Por otra parte, la diferencia de electronegatividad entre el H y el F es considerable: χP(H) = 2.20 y χP(F) = 3.98. Como ya se ha mencionado anteriormente, no se consideran los orbitales interiores del flúor (capa 1s).
Los orbitales de tipo σ se forman por la combinación lineal del orbital 1s del H y de los orbitales 2s y 2pz del F. Estos tres orbitales atómicos se combinan dando lugar a tres orbitales moleculares σ representados por funciones del tipo:
Ψ= c11sH + c22sF + c32pzF
Los orbitales px y py del F no pueden combinarse con orbitales del H, por lo que quedan inalterados, formando una serie doblemente degenerada de orbitales moleculares de no enlace de simetría π.
El Diagrama de Orbitales Moleculares que resulta se muestra en la figura.
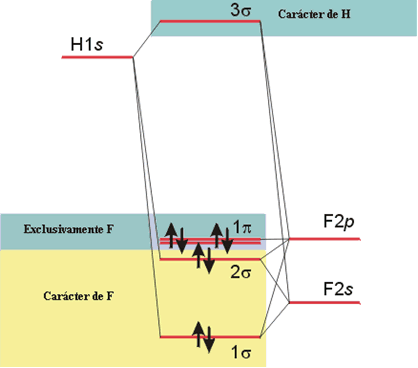
Diagrama de Orbitales Moleculares de HF.
El orbital molecular enlazante 1σ tiene carácter predominantemente del F (de acuerdo con su mayor electronegatividad), debido a que el orbital 2s del F contribuye en mayor medida a la combinación lineal de enlace. El orbital 2σ es un orbital predominantemente de no enlace y se localiza en el átomo de F. El orbital molecular antienlazante 3σ tiene carácter predominantemente del H por ser el átomo menos electronegativo.
Dos de los ocho electrones disponibles para el enlace en la molécula de HF ocupan el orbital molecular enlazante 1σ y los seis restantes se distribuyen entre los orbitales moleculares 2σ y 1π, que son de no enlace. La configuración electrónica para esta molécula es: 1σ2 2σ2 1π4. Es importante señalar que todos los electrones en esta molécula ocupan orbitales localizados sobre el átomo de F y como consecuencia de ello, el enlace H-F está polarizado, con una carga parcial negativa sobre el F y una carga parcial positiva sobre el H. El momento dipolar observado para esta molécula es de 1.91 D. El orden del enlace para la molécula de HF es 1, pues sólo hay un par de electrones ocupando un orbital molecular enlazante.
La molécula de monóxido de carbono (CO).
El diagrama de orbitales moleculares de la molécula de CO (isoelectrónico con el CN-) es más complejo que el de la molécula de HF porque ambos átomos poseen orbitales 2s y 2p en sus capas de valencia. La diferencia de electronegatividad entre los átomos de oxígeno y de carbono es grande: χP(C) = 2.55 y χP(O) = 3,44. Hay 8 orbitales atómicos (1 orbital s y tres orbitales p de cada átomo) para formar 8 orbitales moleculares en los que alojar 10 electrones valencia (4 electrones de C y 6 del O). De los 8 orbitales moleculares, cuatro de ellos presentan simetría σ, que se forman por la combinación lineal de los orbitales 2s y 2pz de ambos átomos, y otros cuatro de simetría π, que se forman combinándose linealmente los orbitales atómicos px y py de cada átomo. El Diagrama de Niveles de Energía resultante es el que se muestra en la figura.
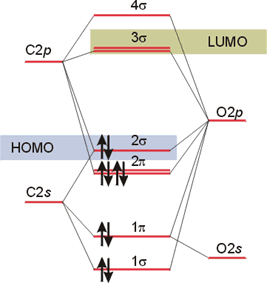
Diagrama de Orbitales Moleculares del CO.
La configuración electrónica, en el estado fundamental, de la molécula de CO es: 1σ2 2σ2 1π4 3σ2 y el orden de enlace encontrado es 3. En este tipo de moléculas la asignación de enlazante, antienlazante o de no enlace no es tan simple como en las homonucleares. En muchos casos es preciso acudir a cálculos computacionales para determinar esta característica de cada orbital. La Figura 16 muestra una representación de los orbitales moleculares de la molécula de CO obtenida mediante uno de estos cálculos (denominado ab initio). El HOMO de esta molécula es el orbital molecular 3σ que corresponde a un orbital fundamentalmente de no enlace localizado sobre el átomo de C. El LUMO está formado por el par de orbitales antienlazantes doblemente degenerado 2π, que tiene carácter fundamentalmente del átomo de C. Esta combinación de orbitales fronteras es muy significativa y explica porqué el monóxido de carbono forma compuestos químicos con los metales de transición.
Aunque la diferencia de electronegatividad entre los átomos de C y O es grande, experimentalmente se observa que el valor del momento dipolar para la molécula de CO es muy pequeño (0,1 D). Además, el extremo negativo del dipolo se encuentra localizado sobre el átomo de C, a pesar de ser el átomo menos electronegativo. Esta extraña situación se debe a la compleja distribución de los pares de enlace y de no enlace en esta molécula.
Los compuestos hipervalentes
En un capítulo anterior se ha descrito el fenómeno de la hipervalencia, o existencia de más de ocho electrones alrededor del átomo central en una molécula. Tómese por ejemplo la molécula de SF6. Para construir el diagrama de orbitales moleculares hay que considerar lo orbitales 3s y 3p del átomo de S así como un orbital 2p de cada uno de los átomos de flúor, ya que estos orbitales están más cerca en energía a los del azufre. A partir de estos diez orbitales atómicos se obtiene una serie de diez orbitales moleculares, cuyo orden de energía aparece descrito en la figura.
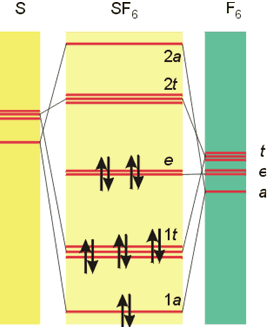
Diagrama de Orbitales Moleculares de SF6.
La notación de los orbitales es más compleja que las anteriores y no se considerará en este curso. Lo sustancial radica en la ocupación por los doce electrones correspondientes de cuatro orbitales moleculares enlazantes (1a y 1t) y de dos de no enlace (e), así como la no ocupación de orbitales antienlazantes, lo que explica la estabilidad de la molécula. Y nótese como para ello no ha sido necesario el concurso de orbitales d, cual era la explicación ofrecida con anterioridad. Así pues, la Teoría de los Orbitales Moleculares explica suficientemente la existencia de compuestos hipervalentes a partir de los orbitales de valencia de los átomos que los forman.
Compuestos deficientes en electrones.
Existe una serie de compuestos que no cuentan con el suficiente número de electrones para escribir una estructura de Lewis. El ejemplo típico es el del diborano, B2H6, cuya estructura es la siguiente:
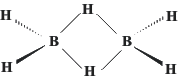
Como quiera que los electrones de valencia suman doce, es obvio que los ocho enlaces dibujados más arriba no pueden ser enlaces de dos electrones por cada dos centros. La teoría de Lewis no puede explicar el enlace de esta molécula, pero la Teoría de Orbitales Moleculares solventa esta dificultad.
El número de orbitales puestos en juego en esta molécula es de catorce: cuatro de cada boro y seis de los hidrógenos. Si se asume que los cuatro enlaces boro-hidrógeno terminal son del tipo covalente clásico, esto es, con dos centros y dos electrones cada uno, quedan únicamente cuatro electrones y seis orbitales para los enlaces de la unidad BH2B. La interacción de esos seis orbitales atómicos da lugar a seis orbitales moleculares: dos de enlace, dos de no enlace y dos de antienlace. Los dos orbitales de enlace están ocupados por los cuatro electrones, lo que supone un orden de enlace de uno para cada agrupación B-H-B. Esto es lo que se denomina un enlace no clásico de tres centros y dos electrones. Este tipo de enlaces no es exclusivo de esta molécula y se da en otras que se comentarán en capítulos sucesivos.
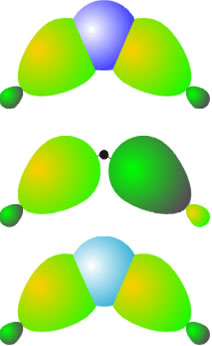
Orbitales moleculares para la agrupación BH2B. De abajo a arriba:enlazante, de no enlace y antienlazante.