Los elementos próximos al F son los que poseen altos valores de I y de Ae y son los más electronegativos. Debido a que cM depende de las energías de los orbitales atómicos y en particular, de la localización de los orbitales frontera, la electronegatividad de un elemento será elevada si los dos orbitales frontera de un átomo tienen baja energía.
La polarizabilidad, a, de un átomo se define como la facilidad que presenta dicho átomo para poder ser distorsionado por un campo eléctrico (como el que produce, por ejemplo, un ion vecino). Un átomo o un anión es altamente polarizable si su distribución electrónica puede distorsionarse fácilmente, como ocurre cuando el orbital vacío o parcialmente ocupado de menor energía está próximo al orbital lleno de mayor energía. En otras palabras, la polarizabilidad de un átomo será alta si la separación entre sus orbitales fronteras es pequeña y por el contrario, será baja si dicha separación es grande. Los átomos que presentan orbitales fronteras muy próximos en energía son los átomos pesados y de gran tamaño como los iones de los metales alcalinos y de los halógenos más pesados. Los átomos pequeños y más ligeros como el flúor y los elementos próximos a él, tienen típicamente una gran separación energética entre sus orbitales fronteras y, por lo tanto, son difícilmente polarizables.
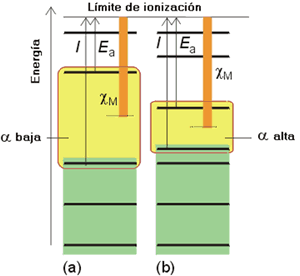
Electronegatividad y polarizabilidad en función de los orbitales frontera.