El modelo de VSEPR (Repulsión de los Pares de Electrones de la Capa de Valencia) es una simple extensión de la teoría de Lewis y sirve para predecir la forma geométrica que adopta una molécula poliatómica. Este modelo fue desarrollado por Sidgwick y Powell en la década de los años 40 y fue extendido posteriormente por Gillespie y Nyholm. Este modelo está basado en la diferencia en estabilidad que confiere a una determinada geometría la disposición respectiva de los pares de electrones, bien de enlace o bien no compartidos, que presente una molécula. Para determinar la geometría de una molécula se aplican las siguientes reglas:
a)Los pares de electrones (compartidos y no compartidos) tienden a situarse en aquellas posiciones que minimicen las repulsiones entre ellos. Las geometrías ideales son:
Nº de pares de electrones |
Geometría |
|---|---|
2 |
Lineal (AB2) |
3 |
Trigonal (AB3 o AB2E) |
4 |
Tetraédrica (AB4 o AB3E) |
5 |
Bipirámide trigonal (AB5 o AB4E) |
6 |
Octaédrica (AB6 o AB5E) |
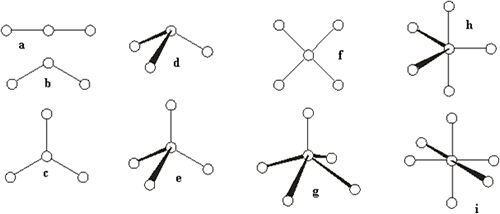
Geometrías moleculares: (a) lineal; (b) angular; (c) plana trigonal; (d) pirámide trigonal (e) tetraédrica; (f) planocuadrada; (g) pirámide cuadrada; (h) bipirámide trigonal y (i) octaédrica.
b) Las repulsiones decrecen en importancia en el orden:
PNC-PNC > PNC-PE > PE-PE
siendo PNC = Par no compartido y PE = par de enlace.
c) Los dobles enlaces ocupan más espacio que los enlaces simples.
d) Los pares de enlace de elementos electronegativos ocupan menos espacio que los de elementos electropositivos.
Para aplicar las reglas de VSEPR hay que determinar el número de electrones de la capa de valencia del átomo central. Para ello se siguen los siguientes pasos:
- Determina el número de pares de electrones. Para ello se contabilizan los electrones de las capas de valencia de los átomos de la molécula.
- Dibuja las posibles estructuras moleculares atendiendo al cumplimiento de la regla del octeto ya a la repulsión mínima entre los pares electrónicos, según el orden comentado anteriormente.
Ejemplos. geometría molecular de las moléculas de CO2, H2O, NH3, SF4, BrF3, ICl2¯.
CO2
Nº electrones = 4 e (C) + 6 x 2 e (2 O) = 16 e = 8 pares de e
Estructura de Lewis:
![]()
Para minimizar las interacciones, los pares de enlace (doble) se disponen de forma lineal. Luego la estructura molecular es lineal.
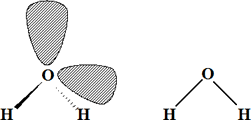
H2O
Nº electrones = 6 e (O) + 2 x 1 e (2 H) = 8 e = 4 pares de e
Estructura de Lewis:
![]()
El átomo central presenta dos pares de enlace y dos no compartidos. Para cuatro pares, la estructura molecular debe ser tetraédrica, y la geometría de la molécula (es decir, la geometría de los átomos y enlaces) es angular:
SF4
Nº electrones = 6 e (S) + 7 x 4 e (4 F) = 34 e = 17 pares de eEstructura de Lewis:
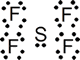
Alrededor del átomo central hay 5 pares de e (compuestos hipervalente), de los que cuatro son de enlace y uno de no enlace (o no compartido). Para cinco pares la geometría debe ser derivada de bipirámide trigonal. En este caso existen dos posibles ubicaciones de los pares de electrones:
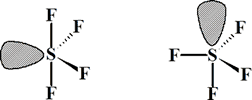
Cuando aparezca más de una geometría posible, se evalúan las interacciones entre los pares de enlace. La geometría de la izquierda presenta 2 interacciones de tipo par no compartido(PNC)-par de enlace(PE) a 90º y otras dos a 120º. La alternativa presenta tres interacciones PNC-PE a 90º y 1 PNC-PE a 180º. Las más importantes son las que involucran PNC, y ya que la segunda presenta 3 al menor ángulo, esta estructura es la más inestable. Así pues, la geometría de esta molécula es la derivada de la distribución de pares de electrones de la izquierda.
NH3
Nº electrones = 5 e (N) + 3 x 1 e (3 H) = 8 e = 4 pares de eEstructura de Lewis:
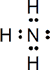
Para los cuatro pares de electrones (3 PE y 1 PNC) sólo existe la distribución tetraédrica, lo que conduce a una geometría molecular de pirámide trigonal:
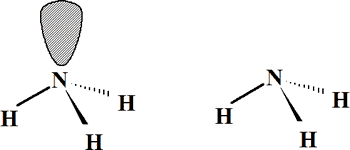
BrF3
Nº electrones = 7 e (Br) + 7 x 3 e (3 F) = 28 e = 7 pares de e
Estructura de Lewis:
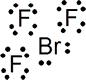
En esta ocasión, existen 5 pares de electrones alrededor del átomo central, de los cuales 3 son de enlace y 2 de no enlace. Para cinco pares, la geometría debe ser derivada de bipirámide trigonal, y son tres las posibles distribuciones de esos cinco pares:
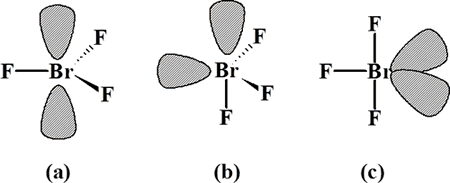
Las repulsiones en cada estructura son:
6 PNC-PE 90º 3 PNC-PE 90º 4 PNC-PE 90º 1 PNC-PNC 120º
La geometría más favorable es
la (c), de donde se deriva que la estructura de esta molécula debe ser
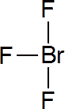
ICl2¯
Nº electrones = 7 e (I) + 7 x 2 e (2 Cl) + 1 e (carga) =22 e = 11 pares de e
Estructura de Lewis:
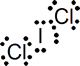
El número de pares alrededor del átomo central es de cinco, por lo que de nuevo se trata de una estructura derivada de una bipirámide trigonal. Para esta molécula pueden dibujarse tres distribuciones distintas:
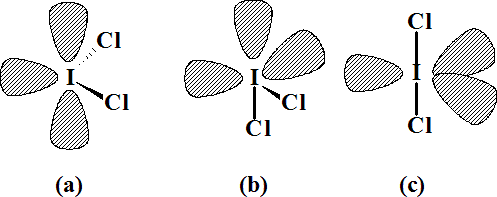
2 PNC-PNC 90º 2 PNC-PNC 90º 4 PNC-PE 90º 3 PNC-PE 90º 6 PNC-PE 90º
La inexistencia de interacciones entre pares no compartidos en (c) avala a esta distribución como la más estable. De ahí la propuesta de linealidad en esta molécula:
![]()
SOF4
Nº electrones: 6 e (S) + 6 e (O) + 7 x 4 e (4 F) = 40 e = 20 pares
Estructura de Lewis:
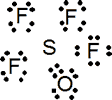
La propuesta del doble enlace S=O se efectúa para minimizar las cargas formales, ya que de sin dicho doble enlace aparecería separación de carga en el enlace S-O. Así pues, el número de pares de electrones alrededor del átomo central es de 4 pares de enlace simple y un enlace doble (equivalente a dos simples). Las dos estructuras posibles son:
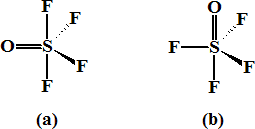
2 PED-PE 90º 3 PED-PE 90º
A efectos de repulsiones, la estructura (a) presenta menor número que la estructura (b), por lo que es la más estable.