Plantas fabricadoras de ácidos.
Tratamientos.
Los desechos de la fabricación de ácidos, son extremadamente contaminantes, por lo cual deben tratarse antes de poderse arrojar en los cursos de aguas. Varios son los puntos importantes, sin embargo, el pH de estos residuos es lo que más atentamente se debe controlar y se debe ver que dicho valor se encuentre en el rango de 6.0 a 9.0.
El principal método de tratamiento que se efectúa a estos efluentes es el de neutralización. Gehm nos describe su método de neutralización de desechos ácidos, que consta de una cama de piedra caliza, la cual trata a los desechos por encima 10.000 p.p.m. de acidez mineral en una cama capaz de recibir 0.1 mgd de desechos. Por otra parte también encontramos el método de Shugart; un proceso que utiliza caliza para una neutralización automática.
Métodos de Spray-burning y Combustión indirecta:
- Spray-burning: Este método consiste en esparcir el desecho ácido en una cámara de combustión a alta temperatura (1700-2000 °F) con pequeñas cantidades de aire en exceso con el fin de oxidar hidrocarburos. El sulfato se transforma en SO2 y los hidrocarburos en CO2 y H2O; los gases son enfriados y secados, y el SO2 es recuperable para su posterior uso en la fabricación de ácido sulfúrico nuevamente.
- Combustión indirecta: La principal reacción de éste método, es la reducción de los excedentes de ácido sulfúrico en el sedimento fangoso por ciertos hidrocarburos que pueden hallarse presente o que se pueden adicionar.
Método de cama de piedra caliza :
Este método es aplicable al caso de que una planta no sólo produzca ácido sulfúrico, sino también otros como el clorhídrico nítrico, etc..
Consiste en una cama de piedra caliza de neutralización ácida, unidad que se emplea en la neutralización de una mezcla de sulfúrico y clorhídrico (comúnmente) en distintas concentraciones. Los desechos deben diluirse hasta que alcancen una concentración de un uno por ciento y luego se los hace pasar a través de dicha cama de piedra caliza hacia arriba por sus tres pies de extensión en cantidades de 20 a 30 galones por minuto por pie cuadrado del área de la cama. El inconveniente es que se debe tener inicialmente un pH que ronde los valores 4,6 a 4,9.
Estos tres últimos métodos son empleados principalmente por empresas que no sólo producen ácido sino también hidrocarburos, sales, etc. Son métodos muy generales.
Proceso de neutralización.
Introducción.
Un desecho industrial con una alta cantidad de contenido de base o ácido, no debería ser descargado a la corriente de agua sin un tratamiento previo. La corriente, aun siendo de baja clasificación (llamamos de baja clasificación a una corriente destinada a recibir desechos y/o para la navegación), es adversamente afectada por valores altos o bajos de pH. Esta condición adversa es todavía más critica cuando repentinamente corrientes de desechos ácidos son impuestos sobre la corriente de agua.
Los tratamientos de los que hablamos anteriormente, son procesos de neutralización, y entre éstos hallamos un alto número de métodos para eliminar el alto contenido de sobreacidez en los efluentes industriales; como por ejemplo:
- mezcla de desechos de modo que el efecto en red de finalmente un pH neutro;
- tratamientos mediante lechos de piedra caliza;
- mezcla de desechos con trozos de piedra caliza o piedra dolomítica;
- el agregado de las correctas proporciones de soluciones concentradas de soda cáustica (NaOH) o ceniza sodada (Na2CO3) a los desechos ácidos.
Los materiales y los métodos deben ser seleccionados en base al costo total de la operación, ya que los costos del material varían ampliamente y los equipos que utilizan varios agentes pueden diferir con el método seleccionado. El volumen, tipo y la cantidad del desecho ácido a ser neutralizado son también factores al decidir qué agente de neutralización se empleará.
En una línea de neutralización, el ingeniero responsable debe de establecer un mínimo aceptable para el valor de pH del efluente y adecuar el tiempo de reacción para el efluente ácido para llegar a dicho valor. Aunque este trabajo previo se considere muchas veces innecesario y costoso. En muchos casos, una fábrica puede reducir los costos de la neutralización mediante la provisión de suficiente tiempo de retención y sacrificando el nivel de eficiencia en el subsecuente tratamiento biológico. Para el tratamiento biológico es siempre conveniente que el valor de pH este cercano a la neutralidad, la neutralización previa le da una mayor eficiente.
Métodos de neutralización.
1°) Mezcla de desechos básicos y ácidos: La mezcla de efluentes puede ser llevada a cabo en una planta simple de operación o entre fábrica vecinas. Desechos ácidos y básicos pueden ser producidos individualmente dentro de una planta y producirse la mezcla de los líquidos en un tiempo apropiado lo que nos permitiría llevar a cabo la neutralización, sin embargo esto requiere usualmente un depósito de cada efluente para abolir corrientes excesivas de uno u otro.
Si una planta produce desechos tóxicos alcalinos, los cuales pueden ser transportados a una planta vecina que produzca ácidos, un económico y fehaciente proceso de neutralización nacerá de ambas. Por ejemplo, una planta de materiales de construcción produce un efluente básico, luego de una ecualización, de alrededor una mitad de mil para mezclar con un efluente ácido de una química, se puede obtener una neutralización total de ambos efluentes; siendo de bajo costo, y evitándose problemas de política y de ingeniería. En otra instancia, se reportó el uso de 500000 galones en reserva, de un digestivo anaerobio para mezclar desechos de planta anteriores al tratamiento. El resultado del valor del pH de la reserva oscilará en rangos de 6.5-8.5.
2°) Tratamiento con piedra caliza: El pasar un efluente ácido a través de lechos de piedra caliza, fue uno de los métodos tradicionales para la neutralización. Los líquidos pueden ser pasados de arriba hacia abajo o viceversa, dependiendo de el origen del aparato y del costo inherente. Se logra escurrir un galón por minuto (gpm) por pie cuadrado o menos. La neutralización procede químicamente acorde a la siguiente reacción:
CaCO3 +
H2SO4 ![]() CaSO4 +
CO2 +
H2O
CaSO4 +
CO2 +
H2O
La reacción continuará mientras dure la disponibilidad de la piedra caliza a la misma, y en estado activo. La primera condición puede encontrarse simplemente mediante la provisión de cantidad suficiente de caliza; la segunda condición es aveces más difícil de mantener. Si se trabaja con una solución de ácido sulfúrico, debe ser diluida a un límite máximo de un 5 % y admisible hasta un rango de 5 gpm/ft2 antes de hacerla pasar por el lecho. No se debe concentrar los esfuerzos en neutralizar el ácido sulfúrico arriba de un 0,3 % de concentración o a un rango menor a 1gpm/ft2 debido a la baja solubilidad del sulfato de calcio. Un exceso de ácido va a precipitar el sulfato de calcio, causando subsecuentemente una capa que pasivará la piedra caliza.
El uso del lecho de piedra caliza puede ser una seria desventaja para este método de neutralización, ya que la piedra caliza gastada debe ser reemplazada por nueva a intervalos periódicos, la frecuencia del reemplazo dependerá de la cantidad y calidad de los desechos ácidos que son pasados a través del lecho. Cuando se produce la existencia extrema de cargas de alta acidez, se puede producir espuma, especialmente cuando se encuetra presente material orgánico en el líquido.
3°) Tratamiento Lime-Slurry: Mezclar desechos ácidos con una mezcla acuosa de cal es un procedimiento efectivo de neutralización. La reacción es similar a la del método de lechos calizos. En este caso, sin embargo, la cal es utilizada constantemente porque es convertida en sulfato de calcio y eliminada con el efluente. Si bien actúa lentamente, la cal posee un alto poder neutralizante y su acción puede ser acelerada por calentamiento u oxigenación de la mezcla. Es un proceso relativamente barato, pero a gran escala el valor puede pasar a ser un ítem importante.
La cal hidratada es a veces difícil de manejar, ya que tiene una tendencia a arquearse, o puentearse, sobre la salida del depósito y posee pobres propiedades de fluidez, pero es particularmente adaptable a los problemas de la neutralización envolviendo pequeñas cantidades de desecho, mientras éste puede ser depositado en embalajes con la ventaja de no tener que construir depósitos especiales.
En casos actuales, la neutralización del ácido sulfúrico en concentraciones por encima de un 1.5%, fue llevada a cabo satisfactoriamente por el uso de piedra dolomítica al rojo (muy alta temperatura) que contiene 47.5% de óxido de calcio, 34.3% de óxido de magnesio y un 1.8% de carbonato de calcio. La concentración de ácido fue limitada hasta el estado de un 1.5%, debido a la ausencia de agua para diluir y así variar los porcentajes. Esta cal provee la ventaja adicional de retener el sulfato residual hasta un mínimo, una imposibilidad con cualquiera de los métodos de lechos cálcicos.
4°) Tratamiento de la soda cáustica: El agregado de soluciones concentradas de hidróxido de sodio a los desechos ácidos como así también el agregado de carbonato de calcio en concentraciones apropiadas resultan rápidos aunque costosos procesos de neutralización. Pequeños volúmenes del agente son requeridos, ya que estos neutralizantes son mucho más poderosos que la caliza y la cal. Otra ventaja es que los productos de la reacción son solubles y no aumentan las durezas a las aguas que se reciben. La soda cáustica es mezclada normalmente en la parte de succión de la bomba de descarga de los efluentes. Este método es apropiado para pequeños volúmenes, pero para neutralizar grandes volúmenes de desecho acuoso, se necesitan especiales equipos, de grandes dimensiones, como un depósito para el almacenamiento del neutralizante con una bomba de diversas velocidades para la directa adición del álcali a la corriente del desecho.
Discutimos hasta ahora cuatro métodos para neutralización, sería conveniente el estudio de los costos de la neutralización de desechos y de los agentes que hemos considerados.
Ya que el factor de basicidad (ver tabla adjunta), es una de los factores vitales en la selección de un neutralizante, se nos proviene no sólo de un cálculo, sino también un monograma para calcular la cantidad de agente neutralizante requerido por galón de desecho. Se determina así el valor de ácido por titilación de 5 ml de ácido sulfúrico con exceso de hidróxido de sodio 0,5 N y una contratitulación con ácido clorhídrico 0,5 N donde el punto final de la titulación lo marca el viraje de color de la fenolftaleína. El factor de basicidad de la cal ( o agente neutralizador) es determinado por la titulación de 1 mg de muestra de agente alcalino con exceso de ácido clorhídrico 0,5 N, hirviendo la muestra por quince minutos, y contratitulando con hidróxido de sodio, donde el punto final de la titulación lo da el viraje de color de la fenolafteína. El valor del ácido y del factor de neutralización son luego conectados en el monograma de HOAK para encontrar la cantidad de agente requerido por galón de desecho ácido.
Cuando el hidróxido de sodio es usado como neutralizante para el ácido sulfúrico, las siguientes ecuaciones tienen lugar:
NaOH + H2SO4 ![]() NaHSO4 +
H2O,
NaHSO4 +
H2O,
desecho ácido
NaHSO4 +
NaOH ![]() Na2SO4 +H2O.
Na2SO4 +H2O.
La neutralización se produce en dos pasos y los productos finales dependen del valor requerido para el pH final. Por ejemplo, un tratamiento necesita de un pH final de 6, y el NaHSO4 formaría la mayor parte del producto; otro tratamiento podría requerir un pH de 8, con lo cual la mayor parte del producto será Na2SO4.
Efluentes gaseosos
Control de los efluentes gaseosos.
Una norma sancionada por la experiencia es que toda materia prima debe conocerse a fondo antes de utilizarla. por tanto, habrá que aplicar este criterio a la contaminación, ya que la materia prima que la provoca son los productos de combustión que, por tanto, se deben conocer perfectamente.
Se vio que uno de los factores o parámetros que inciden sobre la contaminación gaseosa detectable en un punto cualquiera es la sobrelevación del penacho de humos, que a su vez depende de las energías térmicas y cinética que se le comunique. Por tanto, es preciso determinar la velocidad y temperaturas de los humos.
Como por otro lado se sabe que en el combustible una cierta cantidad de azufre, como impureza, aunque también la proporción del mismo es muy variable, será preciso determinar las cantidades reales de anhídrido sulfúrico y sulfuroso emitidas.
Aunque la eficacia de los precipitadores electrostáticos y mecánicos utilizados en la eliminación de polvo de los gases de combustión es de sobra conocida, también se sabe que la resistividad y abrasividad de las cenizas volantes es variable, como consecuencia de las diversas procedencias del carbón que alimenta a la central, el rendimiento de los precititadores varia. En consecuencia, otro dato que hay que determinar en el efluente será el contenido de polvo de los gases de combustión y el rendimiento de la precipitación.
Por ultimo, si la combustión de la caldera no tiene la eficacia deseable, probable que se alcance un valor de la escala Ringelmann superior a 2, lo que plantea la necesidad de medir la densidad óptica de los humos emitidos.
A continuación se examinaran los diversos sistemas de control utilizados, en los que únicamente se estudia el principio físico en que se basan pues se prescinde de cualquier tipo concreto de aparato.
El control continuo de la opacidad de los gases de la combustión se efectúa de la forma siguiente: en un tramo recto de la tubería de conducción de humos, ver figura, se coloca el sistema fotoeléctrico de control, que consta, por una parte, de un dispositivo de proyección luminosa de intensidad constante y, por otra, y exactamente en frente de esta, el sistema receptor, constituido por una célula fotoeléctrica que mide la intensidad luminosa recibida y a continuación la registra en un dispositivo de control.
Si se considerase deseable, se puede acoplar a este equipo una unidad de control remoto y un sistema de alarma calibrado de acuerdo con la legislación vigente o bien de tal modo que permita determinar la eficacia de la combustión, pues cuanto mayor sea la intensidad luminosa tanto mas eficaz será la combustión.
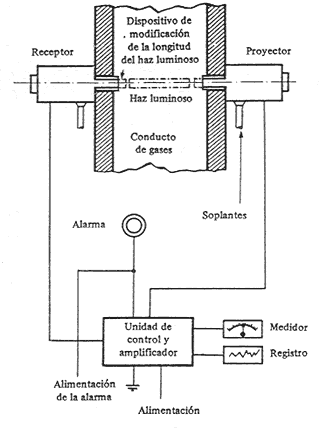
Esquema
de dispositivo fotoeléctrico
de medida de opacidad de los gases
Por regla general, los sistemas emisor y receptor de estos equipos van provistos de unos dispositivos que tienen acortar o alargar el recorrido del haz luminoso por el humo, si ello es preciso. Además, para evitar los atascos producidos por la acumulación de polvo y hollín en la conducción del equipo, el aparato dispone de un aparato de limpieza automática.
Con estos sistemas de medida el encargado de la caldera esta siempre al corriente de la marcha de la combustión y, por lo tanto, cuando sea preciso, puede adoptar las medidas necesarias para que aquella pueda mantenerse en todo momento en condiciones optimas de régimen.
Por regla general, aun cuando funcionen bien, las centrales térmicas emiten humos de opacidad superior a la normal durante periodos cortos de tiempo que se corresponden con el encendido a partir de la caldera fría hasta alcanzar el mínimo técnico de carga.
Determinación del dióxido de azufre.
El método de valoración mas usado para este compuesto es el que utiliza iodo como reactivo. Para ello se prepara una disolución del elemento de normalidad adecuada, (generalmente N/100) que se valora convenientemente.
Un pequeño volumen de esta disolución (10-40 ml) se coloca en un frasco lavador con placa perforada, adicionándole almidón como indicador.
Se disponen adecuadamente los aparatos medidores de temperatura y presión, tanto en el conducto efluente, como en el conducto analizador, así como un medidor se caudal, según se indico con anterioridad.
La corriente gaseosa se hace pasar a través de un frasco lavador, interrumpiéndose la operación en el momento justo en que la coloración del reactivo absorbente desaparece.
Conocida la concentración de iodo en la disolución, unos sencillos cálculos permiten determinar cuantitativamente el dióxido de azufre que ha reaccionado en el frasco lavador. El volumen de corriente gaseosa se corrige si es necesario en función de la presión y temperatura medidos, y los resultados pueden expresarse en p.p.m. o bien en porcentaje.
Compuestos de azufre
El azufre es un elemento que se encuentra presente en diversas proporciones en gran parte de los combustibles. Durante el proceso de combustión se combina con el oxigeno para formar los correspondientes óxidos, de os cuales los mas importantes son el dióxido y el trióxido.
Las cantidades de estos compuestos que se vierten a la atmósfera son extraordinariamente elevadas, alcanzando cifras de millones de toneladas al año.
A temperatura ambiente, el dióxido de azufre es un gas que condensa con facilidad. Es incoloro, de olor picante e irritante y más pesado que el aire, poseyendo un elevado poder de corrosión. Químicamente puede actuar como oxidaste (por ejemplo frente al sulfuro de hidrogeno), o como reductor (con los halógenos).
El trióxido de azufre es un liquido incoloro de elevada afinidad por el agua, con la que forma ácido sulfúrico, y de propiedades oxidasteis. La aparición de este compuesto en la atmósfera se puede deber a tres causas:
- Oxidación directa del SO2
- Oxidación catalítica del SO2
- Descomposición de los sulfatos presentes en los combustibles
De las tres formas posibles, parece ser la segunda la que interviene en mayor escala, actuando como catalizadores diversos compuestos metálicos existentes en las porciones inorgánicas de los combustibles.
La concentración de dióxido de azufre en la atmósfera presenta variaciones típicamente estacionales debido al mayor empleo de combustibles las épocas frías del invierno.
Efecto sobre las plantas.
La contaminación atmosférica afecta a los vegetales de diferentes maneras. A grandes rasgos los dados ocasionados pueden agruparse en los tres siguientes grupos:
- Afecciones de los tejidos de las hojas con necrosis parciales.
- Clorosis y otros cambios de color.
- Alteraciones en el crecimiento.
Estas afecciones obedecen a dos causas diferentes:
- Penetración directa de los contaminantes en los vegetales a través de los estomas de las hojas
- Deposición sobre las diferentes partes de la planta, influyendo e la fotosíntesis.
Las afecciones en los tejidos de las hojas provocan la plasmolisis de las células vegetales que puede ser parcial si el causante es el nitrato de peracetilio (PAN) o el ozono, o total en los compuestos fluorados y del dióxido de azufre. Las hojas afectadas presentan primeramente un suave aspecto de estar empapadas en agua y algunas magulladuras pequeñas.
La clorolisis es la perdida de clorofila, pigmento natural de las plantas, y puede se comparada con la anemia de los animales. La desaparición de la clorofila da lugar a nuevos colores a partir de otros pigmentos presentes. Por regla general, la coloración es característica del contaminante que esta causando el fenómeno. Así, por ejemplo, una coloración blanquecina es producida por el dióxido de azufre y una marrón por el flúor.
Lógicamente, las afecciones de las hojas de los vegetales, donde se produce la transformación de numerosas sustancias inorgánicas en otras nutritivas para la planta, puede afectar seriamente el crecimiento de ella.
En la práctica, han sido observadas numerosas deficiencias con ciertas plantas situadas en ambientes muy contaminados, tales como, perdida precoz de las hojas, disminución del tamaño del fruto, crecimiento inferior al normal y prematuro envejecimiento general.
El crecimiento de la planta, concretamente, se ve seriamente afectado por la contaminación atmosférica, pues esta tiene una influencia muy fuerte sobre la auxina, hormona vegetal muy importante en la regulación de la evolución general de la planta, y cuya acción es afectada por cantidades de contaminantes sumamente débiles.
Dióxido de azufre
Las lesiones que produce en las plantas son normalmente de origen local. Las células admiten cierta concentración máxima del compuesto, que cuando es superada provoca el fin de su actividad y la muerte posterior.
Esta toxicidad se atribuye generalmente a las propiedades reductoras del dióxido, y la coloración característica que comunica a las zonas afectadas es de tonos amarillentos y rojizos.
La sensibilidad de las diferentes plantas a este contaminante es muy variedad. Experimentalmente ha podido ser determinada la resistencia relativa de numerosas especies y que se atribuye a la alfalfa el valor unidad.