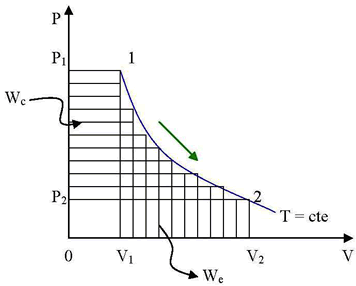
Proceso Politrópico
Calor Intercambiado:
Por el primer principio y la ecuación (22), para un mol de gas ideal
δQ = C.dT = CV.dT + P.dV entre dos estados 1 y 2:
![]()
(pues C = cte)
Variación de Energía Interna
De la ecuación (6): dU = CV .dT, entre dos estados 1 y 2:
![]()
(suponiendo que CV = cte)
Variación de la entalpía
De la ecuación (13): dH = CP.dT
![]()
(suponiendo que CP = cte)
Trabajo exterior
Cuando se conocen las capacidades caloríficas molares C y CV, se puede calcular W aplicando el Primer Principio:
Q = ΔU + W por lo tanto W = Q - ΔU reemplazando:
W = C (T2 - T1) - CV(T2 - T1) = (C - CV) (T2 - T1) (29)
Si se conoce el exponente politrópico n , partimos de la ecuación:
![]()
Reemplazando:
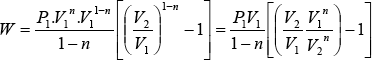
Reemplazando K y sacando factor común V11-n
![]()
Como P1.V1n = P2.V2n
por lo tanto
![]()
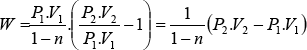 (30)
(30)
O también , como P1.V1 =R.T1 y P2.V2 = R.T2
![]() (31)
(31)
Trabajo de circulación
Conociendo C y Cp se puede calcular Wc aplicando la ecuación del primer principio:
Q = ΔH + Wc
por lo tanto
Wc = Q - ΔH
reemplazando:
Wc = C(T2 - T1) - Cp (T2 - T1) = (C - Cp)(T2 - T1) (32)
Conociendo el exponente politrópico partimos de la ecuación:
![]()
De donde
![]()
Reemplazando:
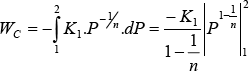
![]()
multiplicando por (-1) numerador y denominador y reemplazando K1:
![]()
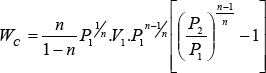
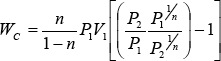
como:
![]()
![]()
![]() (33)
(33)
O también:
![]() (34)
(34)
Relación entre el trabajo exterior y el trabajo de circulación
Si comparamos las ecuaciones (31) y (34), deducimos que entre dos estados de una transformación politrópica, se cumplirá:
Wc = n.W (35)
o sea que el trabajo de circulación es igual al trabajo exterior multiplicado por el exponente politrópico. En una transformación isotérmica donde n = 1, ambos trabajos son iguales.
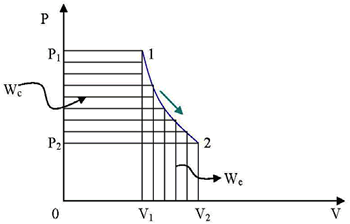
Proceso Adiabático
En un proceso adiabático : Q =0 , C=0 , ![]() La ecuación de una adiabática será: (reemplazando n por γ en las
La ecuación de una adiabática será: (reemplazando n por γ en las
ecuaciones (26) , (27) y (28):
Tomando como parámetros P y V:
V.Pγ = cte
Tomando T y V :
V.Tγ−1 = cte
Tomando T y P:
![]()
Calor intercambiado
Como ya dijimos: δQ = 0 en consecuencia Q = 0, entre los estados 1 y 2.
Variación de energía interna
![]()
Variación de entalpía
![]()
Trabajo exterior
En la ecuación (29), como C = 0 , se cumple que:
W = CV(T2 - T1) = CV(T1 - T2)
Expresión que podría obtenerse del primer principio:
W = Q - ΔU = -ΔU = CV(T2 - T1) = CV(T1 - T2)
Esta ecuación nos dice que en una expansión adiabática, donde W es positivo, la diferencia T1 – T2 debe ser positiva, es decir T2>T1. Esto indica de que en la expansión adiabática el gas sufre un enfriamiento.
También se puede obtener una expresión del trabajo exterior, a partir de las ecuaciones (30) y (31), reemplazando n por γ.
![]()
Trabajo de circulación
Reemplazando C=0 en la ecuación (32)
WC = - CP(T2 - T1) = CP(T1 - T2)
O también por la expresión del primer principio:
WC = Q - ΔH = -ΔH = CP(T2 - T1) = CP(T1 - T2)
Obtenemos otras ecuaciones reemplazando n por γ en (33) y (34):
![]()
ó
![]()
Relación entre We y WC
Reemplazando n por γ en la ecuación (35) se cumple:
WC = γ.We
Proceso Isobárico
En un proceso isobárico P=cte , C = CP y n = 0
Calor intercambiado
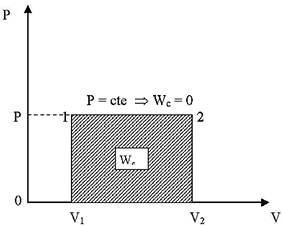
Aplicando la ecuación (22) para un mol de gas:
δQ = C.dT = CP.dT Para dos estados 1 y 2:
![]()
También se puede calcular aplicando la expresión del primer principio:
Q = ΔU + W
Variación de la energía interna
![]()
Variación de entalpía
![]()
Se puede observar que Q = ΔH
Trabajo exterior
Aplicando la ecuación (29) y como C = CP, resulta:
W = (CP - CV)(T2 - T1) y por la ecución de Mayer:
W = R.(T2 - T1)
También se puede calcular aplicando la ecuación: ![]()
Como P es constante: W = P(V2 - V1)
Trabajo de circulación
Reemplazando C =CP en la ecuación (32) resulta
W = (CP - CP)(T2 - T1) = 0
Este mismo resultado se obtiene aplicando la ecuación:
![]() como P = cte entonces dP=0 luego: WC=0
como P = cte entonces dP=0 luego: WC=0
O también de las ecuaciones (33) y (34) pues n=0.
Proceso Isocórico
En un proceso isocórico V=cte , C = CV y n = ∞
Calor Intercambiado
Aplicando la ecuación (22) para un mol de gas:
δQ = C.dT = CV.dT
Para dos estados 1 y 2:
![]()
Variación de energía interna
![]()
Se puede observar que en esta transformación Q=ΔU
Variación de entalpía
![]()
Trabajo exterior
Aplicando la ecuación (29) y como C = CV, resulta:
W = (CV - CV)(T2 - T1) = 0
También se puede calcular aplicando la ecuación: ![]()
como V=cte entonces dV=0 luego W=0
También se verifica que W es nulo si reemplazamos n=∞ en las ecuaciones (30) y (31).
Trabajo de circulación
Reemplazando C =CV en la ecuación (32) resulta
W = (CV - CP)(T2 - T1) = (CP - CV)(T1 - T2) = R(T1 - T2)
Este mismo resultado se obtiene aplicando la ecuación:
∫−=21.dPVWC como V = cte
WC = - V(P2 - P1)= V(P1 - P2)
Proceso Isotérmico
En un proceso isotérmico T=cte, C=∞ n=1
Calor intercambiado
Para calcular Q no podemos aplicar la ecuación (22) pues llegaríamos a una indeterminación, ya que C=∞ y dT=0.
Recurrimos entonces a la expresión del primer principio:
Q = ΔU + W como veremos que ΔU=0, directamente Q=W
Variación de energía interna
![]() como dT =0 entonces ΔU=0
como dT =0 entonces ΔU=0
Variación de entalpía
![]() como dT=0 entonces ΔH=0
como dT=0 entonces ΔH=0
Trabajo exterior
Para calcular W no podemos utilizar la ecuación (29) pues llegamos a una indeterminación. Debemos aplicar entonces la ecuación:
![]()
Como para un mol de gas ideal P.V=R.T entonces ![]() reemplazando
reemplazando
![]()
como también se cumple la ecuación P.V =cte ya que en la (26) se puede reemplazar n=1, será:
P1V1 = P2V2 luego ![]() y también:
y también: ![]()
Trabajo de circulación
Por la misma razón explicada anteriormente, el trabajo de circulación se deberá calcular mediante la ecuación:
![]()
reemplazando:
![]()
![]()
Se puede observar que WC = W, lo cual cumple la ecuación (35).