Enunciado de Clasius: el calor no puede pasar de forma espontánea de una fuente fría a otra más caliente.
Enunciado de Lord Kelvin: no todo el calor de una fuente puede transformarse en trabajo; sino que parte de ese calor deberá cederse a una fuente a menor temperatura.
Enunciado de Kelvin-Planck: es imposible la existencia de una máquina que solamente absorba calor y produzca trabajo.
Enunciado de Ostwald: el móvil o motor de segunda especie es imposible. El móvil de segunda especie se define como una máquina monoterma.
Enunciado de Caratheodory: en el entorno de cualquier estado de un sistema cerrado existen siempre estados que son inaccesibles por vía adiabática.
Enunciado de Sears-Kestin: de un sistema adiabático y rígido (V constante) no podemos obtener trabajo, solo podemos aportarlo. La energía interna solo puede aumentar.
Los enunciados anteriores del Segundo Principio, que surgen inmediatamente de la observación de la naturaleza, no son excluyentes sino se complementan y se explican unos a otros. Todos ellos reflejan la imposibilidad de ciertas transformaciones energéticas. Así, el enunciado de Clasius, que fue históricamente el primero, habla de la imposibilidad de transmitir calor de una fuente a otra de mayor temperatura.
Los enunciados de Lord Kelvin, Kelvin-Planck y Ostwald, consideran la limitación de la conversión de calor en trabajo, en el sentido de que es necesaria una fuente fría para que una máquina térmica produzca trabajo, cediéndole a aquella calor.
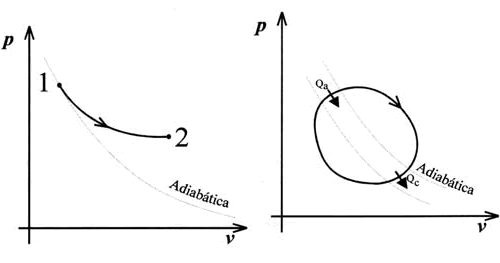
Los enunciados anteriores del segundo principio de la Termodinámica no niegan la producción de trabajo a partir de una absorción de calor en un proceso no cíclico.
Estos enunciados se refieren a que si el proceso es cíclico, la máquina absorbe calor de una fuente caliente y forzosamente debe ceder calor a una fuente fría para poder regresar al estado inicial como se ve en la figura de la derecha.
Los enunciados de Caratheodory y Sears-Kestin se refieren a la imposibilidad de realizar ciertos procesos termodinámicos, siendo el segundo una particularización del primero. Si consideramos un sistema adiabático y rígido como el representado en la figura de abajo, se puede adivinar de forma clara que jamás podremos reducir la energía interna del sistema, transformándose en trabajo en la hélice. Los estados de menor energía interna son pues inaccesibles por vía adiabática tal como predice el segundo principio de la Termodinámica.
Consecuencias del segundo principio
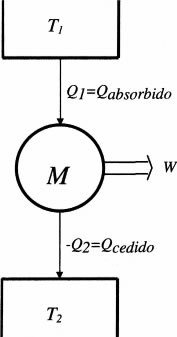
Una de las consecuencias más importantes, desde el punto de vista de la ingeniería, del segundo principio es la limitación en el rendimiento de las máquinas térmicas. En efecto el segundo principio impone que las máquinas térmicas deben intercambiar calor de al menos dos focos, absorbiendo calor de un foco caliente a temperatura T1 y cediendo calor a un foco frío a temperatura T2.
Se define el rendimiento de una máquina térmica de ciclo directo al cociente entre el trabajo producido por la máquina y el calor absorbido de la fuente caliente. Esta definición tiene un sentido ciertamente económico, pues es ese calor absorbido el que se obtendrá generalmente de la combustión de un combustible. Según la notación de la figura, se tiene:
![]()
aplicando del primer principio, el trabajo será igual la diferencia entre el calor absorbido y cedido, por ser el funcionamiento de la máquina cíclico.
ΔU = ΣQi – W = 0
W = Q1 + Q2 = Qabsorbido — Qcedido > O
![]()
El rendimiento de una máquina térmica será siempre inferior a la unidad debido a la limitación de ceder calor a una fuente fría que impone el segundo principio de la Termodinámica. Este rendimiento será más próximo a 1, cuando menor sea la proporción entre calor cedido frente a calor absorbido. En las máquinas térmicas con ciclo inverso conseguimos cambiar el sentido de flujo de calor, absorbiendo calor del foco frío y cediéndolo al caliente gracias a un aporte exterior de trabajo. La idea de rendimiento de la máquina cambia, puesto lo que obtenemos de esta máquina es una absorción de calor y no un trabajo como en la máquina directa. El rendimiento se define pues de manera distinta, y para diferenciarlo se le llama de forma distinta. La eficiencia de una máquina térmica inversa (ε) se define como el cociente entre el calor absorbido por la máquina del foco frío y el trabajo absorbido por la máquina. La eficiencia de la máquina inversa también es conocida como coeficiente de efecto frigorífico.
![]()
ΔU= ΣQi - W = 0
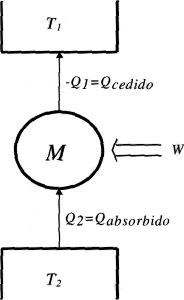
W = Q2 + Q1 = Qabsorbido – Qcedido < 0
Qcedido > Qabsorbido
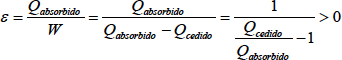
Al contrario que el rendimiento de las máquinas directas, la eficiencia de las máquinas frigoríficas no está limitada en 1, incluso es habitual que sea varias veces superior a uno.
En las aplicaciones en que se utiliza la máquina inversa como bomba de calor es decir, para calefacción, aprovechamos el calor cedido al foco caliente. En este caso resulta más útil definir la eficiencia con respecto al calor cedido. El coeficiente de calefacción se define pues como el cociente entre el calor cedido y el trabajo absorbido por la máquina. El coeficiente de calefacción es siempre superior la unidad.
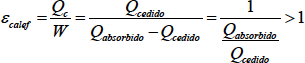
La idea de Carnot consistió en crear un ciclo completamente reversible, tanto internamente (ausencia de rozamientos) como externamente. Carnot ya intuía que una máquina térmica debe de ceder calor a una fuente fría. Por eso, el pensó en una máquina que intercambiaba calor con dos focos. Para eliminar las irreversibilidades externas, la absorción y cesión de calor a los focos debían hacerse a la temperatura de los focos, que es constante. Para respetar esta última condición, el ciclo debe tener dos isotermas, una a la temperatura del foco caliente, en la que se absorbe calor, y otra a la temperatura del foco frío en la que se cede calor. El ciclo se cierra con dos procesos adiabáticos para que la máquina no intercambie calor con ningún foco adicional. Finalmente, el ciclo de Carnot está formado por los procesos que exponemos a continuación.
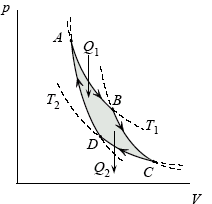
El fluido de trabajo de la máquina térmica empieza absorbiendo calor del foco caliente en proceso isotermo a la temperatura del foco caliente Ta. Seguidamente el fluido se expande de manera adiabática hasta alcanzar la temperatura del foco frío Tc. La máquina cede calor a temperatura constante y por último se comprime el fluido de trabajo hasta alcanzar la temperatura Ta. Se ha representado el ciclo de Carnot para gas ideal en la figura a continuación:
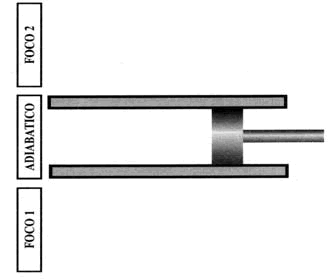
El ciclo de Carnot podría materializarse en la práctica de la manera que se muestra en la figura. Disponemos de un fluido (p. ej. gas ideal) confinado en un cilindro provisto de un émbolo sin rozamientos que se mueve alternativamente entre un volumen máximo y un volumen mínimo. La base del cilindro puede ponerse en contacto de forma sincronizada con el movimiento del émbolo, con la fuente caliente, con una pared aislante, con la fuente fría y con la pared aislante, de la misma manera como hemos descrito en el ciclo. Por simplicidad, vamos a calcular el rendimiento de la máquina de Carnot para el caso particular de un gas perfecto, ya que se trata de un fluido conocido. Calculemos la energía puesta en juego en cada uno de los cuatro procesos elementales:
a) Expansión isoterma, en ella, el cilindro entra en contacto con el foco caliente Ta experimentando una expansión reversible:
q12 = qabs = w12 = RTa ln v2/v1
b) Expansión adiabática, el cilindro se pone en contacto con la pared aislante. El fluido evoluciona de manera adiabática hasta la temperatura Tc
q23 =0 ; w23 = cV (T3 – T2)
c) Compresión isoterma, la base del cilindro se pone en contacto con la fuente fría y el émbolo invierte el sentido.
q34= - qced= w34 = RTc lnv4/v3
d) Compresión adiabática, el émbolo continúa comprimiendo mientras la base del cilindro se pone en contacto con la pared aislante, hasta alcanzar la temperatura Ta.
q41 = 0 ; w41=cV(T1– T4)
Por tratarse de un proceso cíclico, la variación de la energía interna del gas ideal es nula a lo largo del ciclo. La aplicación del primer principio nos permite calcular el rendimiento de la máquina de Carnot.
Δυciclo = qciclo - wciclo = Σqi – Σwi
qciclo = q12 + q34 = qabs - qced = w12 + w23 + w34 + w41 =
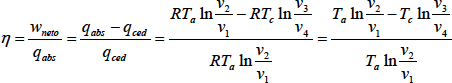
Puesto que los procesos 2-3 y 4-1 son adiabáticos, se cumple:
Tav2γ-1= Tcv3γ-1
![]()
![]()
Con este resultado la expresión del rendimiento puede simplificarse
![]()
Las conclusiones que podemos sacar de este resultado son, por un lado, que todas las máquinas reversibles que funcionan entre dos focos a las mismas temperaturas Ta y Tc, tienen el mismo rendimiento térmico. Además, este rendimiento no depende del fluido de trabajo, solamente de la temperatura de los focos como se desprende de la expresión obtenida (esto justifica a posteriori nuestro empleo del gas perfecto). Se observa que el ciclo tendrá mayor rendimiento cuanto mayor sea la temperatura del foco caliente y menor sea la temperatura del foco frío.
Por otra parte, se puede demostrar que el rendimiento de una máquina irreversible que opere entre dos focos a las mismas temperaturas, será siempre menor que el rendimiento de la máquina reversible.
También se puede demostrar que el rendimiento de una máquina reversible que opere con más de dos focos, será siempre inferior que el rendimiento de una máquina reversible que opere con dos focos a las temperaturas extremas de la primera máquina.
Como conclusión, el ciclo de Carnot establece el máximo rendimiento térmico que puede alcanzar una máquina térmica. Así pues, se cumple:
![]()