Por Heber Gabriel Pico Jiménez MD
Resumen
En este trabajo gracias a la nueva regla del octeto se logra demostrar que la calidad de los enlaces químicos la definen, no solamente el número de electrones que tenga el acoples, sino que también participan eligiendo al tipo de unión, el número de huecos que hayan. Es por esto que ha existido confusión con la resonancia en los distintos enlaces covalentes que aunque presentan los mismos dos electrones, ostentan longitudes distintas. Este trabajo encuentra que habrán unos enlaces covalentes con dos electrones y dos huecos, mientras también existen otros enlaces covalentes que aunque también constan de dos electrones tienen un solo hueco. Este artículo sostiene la nueva regla del octeto haciendo la descripción en las moléculas hipervalentes que han sido confundidas con la resonancia como los óxidos y ácidos de azufre, los compuestos organosulfurados, los fosfatos y los distintos óxidos de nitrógenos. Esta teoría descubre al nitrógeno como hipervalente y demuestra que el ácido sulfúrico, el ácido fosfórico y el ácido nítrico son hipervalentes. Este artículo rompe definitivamente con la teoría de los enlaces axiales de tres centros y cuatro electrones.
Palabras claves: Células Fotoeléctricas, Células Fotovoltaicas, Panel Solar.
Abstract
In this work thanks to the new rule of byte is achieved to demonstrate that the quality of the chemical bonds define it, not only the number of electrons that have the fittings, they also participate by choosing the type of union, the number of holes that have. That's why there has been confusion with the resonance in the different Covalent bonds that although two electrons have the same, they have different lengths. This work is that there will be some covalent bonds with two electrons and two holes, while there are also other Covalent bonds that although they consist of two electrons have a single hole. This article argues the new rule of the octet by the description in the molecules hipervalentes which have been confused with the resonance as oxides and acids of sulfur, the organosulfur compounds, phosphates, and various oxides of nitrogen. These theories see nitrogen as hypervalent shows that sulfuric acid, phosphoric acid and nitric acid are hipervalentes. This article breaks definitively with the theory of the axial bonds of three centres and four electrons.
Keywords: Photoelectric cells, photovoltaic cells, Solar Panel.
1. Introducción
Precisamos que todo el desarrollo de este artículo, estará siempre sostenido en el principio de que químicamente los electrones por lo general, estarán casi siempre apareados. Bajo este principio se desarrollan los anteriores trabajos de energía atómica Número cuántico magnético del electrón, el trabajo de la superconductividad, el artículo del acoplamiento espín-órbita del electrón, además el anterior trabajo de Semiconductores y el de Células fotoeléctricas publicado en textoscientificos y Monografías. También este artículo se basa en la nueva regla del octeto.
En la molécula de monóxido de carbono el átomo de carbono se comporta como un nucleófilo rico en electrones es decir como un carbanión.
2. Desarrollo del Tema.
Como descripciones alternativas en las moléculas hipervalentes, se han intentado modificaciones a la regla del octeto que involucran características iónicas en el enlace hipervalente, adoptando explicaciones con tipos de orbitales moleculares que se forman a partir de orbitales atómicos colineales tipo p. Como concepto más aceptado se ha propuesto el enlace de (3) tres centros con cuatro (4) electrones.
Este concepto además de lo anterior se sostiene también en la premisa adicional de una combinación iónica colineal, triatómica e inestable, que surge como estructura de un Lewis resonante.
Las moléculas de Pentafluoruro de fósforo PF5 y Tetrafluoruro de azufre SF4, tienen solo a dos de los llamados enlaces hipervalentes, que como son iguales se alinean de forma axial. Por lo tanto al primero le restan 3 enlaces covalentes que comparten a dos electrones y dos huecos y al segundo, le quedan solo dos de estos enlaces covalentes ordinarios.
Los enlaces hipervalentes surgen en pares a través de la ruptura que sufren los pares libres de electrones no enlazantes y podrían ubicarse no necesariamente de orientación axial, aunque si son relativamente más débiles que los enlaces covalentes ordinarios.
Llama la atención que en el hexafluoruro de azufre SF6y en los fluoruros de Xenón, todos los enlaces hasta hoy sean descritos con el modelo de tres centros y cuatro electrones, cuando la realidad es otra porque en elSF6, hay dos enlaces covalentes ordinarios que comparten dos electrones y dos huecos pero tienen ubicaciones axiales.
Algunos compuestos moleculares que adoptan la geometría piramidal cuadrada son el Pentafluoruro de cloro, de bromo y de yodo.
La geometría bipiramidad pentagonal, es un tipo de geometría molecular con un átomo central unido a 7 ligandos en las esquinas o vértices de una bipirámide pentagonal, un ejemplo es el heptafluoruro de yodo IF7.
El mecanismo de Bartell es un mecanismo pseudorrotacional similar al mecanismo de Berry que sucede solo en especies con una geometría molecular bipiramidal pentagonal tales como el heptafluoruro de yodo IF7. En este mecanismo se intercambian los ligandos axiales con un par de ligandos ecuatoriales del mismo modo que el mecanismo de Berry lo hace en moléculas piramidales cuadradas planas como pentafluoruro de cloro, bromo o yodo IF5.
ENLACES en las MOLECULAS HIPERVALENTES
Las moléculas hipervalentes tienen a dos tipos distintos de enlaces: a) Enlace covalente ordinario que consta de dos electrones y dos huecos. b) Enlace hipervalente que es un enlace constituido por dos electrones y un solo hueco.
ENLACE COVALENTE ordinario ENTRE ÁTOMOS que COMPARTEN a dos ELECTRONES y dos HUECOS
Según la nueva regla del octeto un enlace covalente ordinario de dos electrones, cada átomo aporta un electrón y un hueco como partícula, quiere decir que el enlace entonces está formado por dos electrones y dos huecos como partículas. Además los átomos intercambian a los huecos.

Enlace covalente ordinario. El par de barras horizontales de color rojo representan a un enlace covalente de dos electrones y dos huecos. Los círculos rellenos de color azul y verde representan a los electrones que le pertenecen al átomo del mismo color. Los círculos vacíos representan a los huecos que le pertenecen al átomo que tiene el mismo color de línea.
Figura No.1.
ENLACE HIPERVALENTE entre ÁTOMOS que COMPARTEN a dos ELECTRONES y un SOLO HUECO
Según la nueva regla del octeto un enlace hipervalente está constituido por dos electrones y un solo hueco. Este enlace consta de dos electrones, cuestión que le permiten confundirse con el enlace covalente ordinario. El átomo central aporta un electrón de la molécula hipervalente aporta únicamente a un electrón y el ligando, aporta un electrón y un hueco.

Enlace hipervalente. El par de barras horizontales de color azul oscuro representan a un enlace hipervalente de dos electrones y un hueco. El círculo relleno de color azul representan al electrón que aporta el átomo central de la molécula hipervalente. El círculo relleno de color verde representa al electrón que aporta el átomo ligando al enlace hipervalente. Los círculos vacíos representan a los huecos que le pertenecen al átomo que tiene el mismo color de línea.
Figura No.2.
MOLÉCULAS HIPERVALENTES que NO tienen ENLACES COVALENTES ORDINARIOS
Son aquellas moléculas en donde no hay enlaces covalentes ordinarios quienes son aquellos enlaces que están constituidos por dos electrones y dos huecos.
Ejemplos de esas moléculas tenemos a los fluoruros de xenón (XeF2, XeF4, XeF6).
Otro ejemplo de moléculas hipervalentes que no presentan enlaces covalentes ordinarios son el ión triyoduro (I3-1).
MOLÉCULAS HIPERVALENTES que TIENEN a UN SOLO ENLACE COVALENTE ORDINARIO
Son aquellas moléculas que tienen a un solo enlace covalente ordinario en el cual cada átomo aporta un electrón y un hueco.
Como ejemplos de esas moléculas tenemos al heptafluoruro de yodo (IF7) que tienen una geometría molecular bipiramidal pentagonal. Además del enlace covalente ordinario tiene a 6 enlaces hipervalentes.
Otra molécula hipotética que tendría un solo enlace covalente ordinario sería el pentafluoruro de yodo (IF5). Además tiene a 4 enlaces hipervalentes y un par de electrones solitarios.
Otra molécula hipotética que tendría un solo enlace covalente ordinario donde cada átomo aporta un electrón y un hueco, sería el trifluoruro de yodo (IF3) y la conocida molécula trifluoruro de cloro (ClF3). Estas moléculas tienen además de dos enlaces hipervalentes, tendrían dos pares de de electrones solitarios.
MOLÉCULAS HIPERVALENTES que TIENEN solo a DOS ENLACES COVALENTES ORDINARIOS
Son aquellas moléculas hipervalentes que tienen a dos enlaces en el cual cada átomo aporta un electrón y un hueco.
Tenemos de ejemplo de esas moléculas al hexafluoruro de azufre (SF6) que tendría una geometría molecular de un octaedro. Presenta además a 4 enlaces hipervalentes.
Otro ejemplo de moléculas hipervalentes que tienen a dos enlaces covalentes ordinarios es la molécula de tetrafluoruo de azufre (SF4). Además tiene a 2 enlaces hipervalentes y un par de electrones solitarios.
Otro ejemplo de moléculas hipervalentes con dos enlaces covalentes ordinarios es la molécula hipervalente del anión sulfato (SO4-2) y el trióxido de azufre (SO3) quienes además tienen el mismo número de enlaces hipervalentes que el SF6.
Otra molécula semejante al SF4 en tener el mismo número de enlaces hipervalentes y no hipervalentes, es el dióxido de azufre (SO2), quien además de los dos enlaces covalentes ordinarios, el átomo central tiene a dos enlaces hipervelentes y además conserva dos electrones libres.
MOLÉCULAS HIPERVALENTES que TIENEN a TRES ENLACES COVALENTES ORDINARIOS
Llamamos enlaces covalentes ordinarios aquellos en que cada átomo participante aporta un electrón y un hueco.
Los ejemplos de moléculas hipervalentes que tengan a tres de esos enlaces están el pentafluoruro de fósforo (PF5). Además tiene a 2 enlaces hipervalentes.
Igual que el PF5 en el sentido de que también tiene el mismo número de enlaces hipervalentes, está el ión fosfato (PO4-3).
En esta lista de moléculas hipervalentes que tienen a 3 enlaces covalentes ordinarios, está el pentaóxido de dinitrógeno (N2O5), está también el ácido nítrico (HNO3), el tetraóxido de dinitrógeno (N2O4), el trióxido de dinitrógeno (N2O3), el oxido de dinitrógeno (N2O) y las azidas (N3-1).
ÁTOMOS de AZUFRE en ESTADO FUNDAMENTAL y EXCITADO

Átomos de azufre donde el átomo de la izquierda corresponde a un átomo de azufre fundamental mientras el azufre de la derecha, es un átomo en estado excitado. Los pequeños círculos rellenos de verde y azul corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Fig. No.3
DIÓXIDO DE AZUFRE
El dióxido de azufre no se origina a partir del monóxido de azufre quien se genera a partir de átomos en estados fundamentales, el dióxido de azufre surge de tres átomos en estados excitados y cada átomo de azufre establece con cada oxígeno, un enlace covalente ordinario que comparte dos electrones y dos huecos además, configura con cada uno de ellos un enlace hipervalente. De los 4 enlaces que tiene el azufre del dióxido, dos de ellos son enlaces hipervalentes y dos son enlaces covalentes compartidos.
En el dióxido el átomo de azufre configura un doble enlace covalente con cada oxígeno, pero ese doble enlace está constituido por dos enlaces distintos, uno de ellos es un enlace covalente que comparte a dos electrones y dos huecos, el otro es un enlace hipervalente que se forma con dos electrones y un solo hueco.
El dióxido de azufre a pesar de que no funciona con la premisa original de Lewis, no viola a la nueva regla del octeto porque el átomo central de azufre, igual que los oxígenos, conservan su octeto individual en su respectiva capa de valencia.
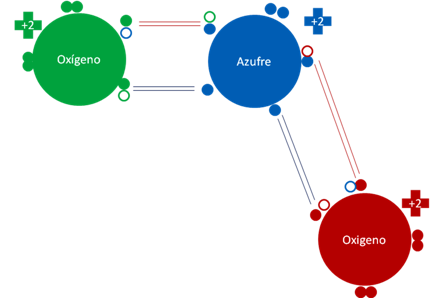
Dióxido de azufre. Los dos pares de barras en color rojo representan a dos enlaces covalentes ordinarios donde los átomos comparten a dos electrones y dos huecos. Los dos pares de barras de color azul oscuro representan a dos enlaces hipervalentes que comparte a dos electrones y un solo hueco. Los pequeños círculos rellenos de distintos colores representan a los electrones de los átomos que tienen su mismo color. Los pequeños círculos vacíos representan a los huecos de los átomos que tienen el mismo color de línea.
Figura No.4.
TRIÓXIDO DE AZUFRE
De los tres oxígenos del trióxido de azufre uno de ellos está unido solo por enlaces hipervalentes mientras los dos oxígenos restantes, están unidos al azufre por un enlace hipervalente y un enlace covalente que comparte dos huecos y dos electrones.
De los seis (6) enlaces que tienen el azufre en el respectivo trióxido del elemento, cuatro (4) de ellos son enlaces hipervalentes y solo dos de estos, son enlaces covalentes que comparte a dos electrones y dos huecos quienes en un futuro van a ser los enlaces de los OH del acido sulfúrico.
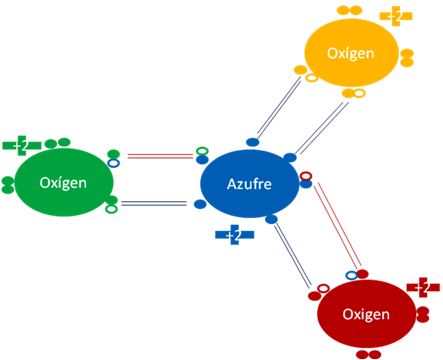
Trióxido de oxígeno. Los cuatro pares de barras en color azul oscuro representan a los 4 enlaces hipervalentes donde los átomos de cada enlace comparten dos electrones pero un solo hueco. Los dos pares de barras en color rojo representan a 2 enlaces covalentes ordinarios donde los átomos en cada enlace comparten dos electrones y dos huecos. Los pequeños círculos rellenos de distintos colores corresponden a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tienen su mismo color de línea.
Figura No.5.
ANIÓN SULFATO SO4-2.
El anión sulfato es la sal o el ester del ácido sulfúrico que se encuentra formado por dos oxígenos que están unidos de forma covalente al azufre. La carga eléctrica de los dos oxígenos laterales es cero (0) pero son relativamente negativos con respecto azufre. Estos dos oxígenos tienen en la figura un electrón adicional representado por un círculo pequeño relleno de color naranja oscuro que se los dejo el enlace iónico del hidrógeno.
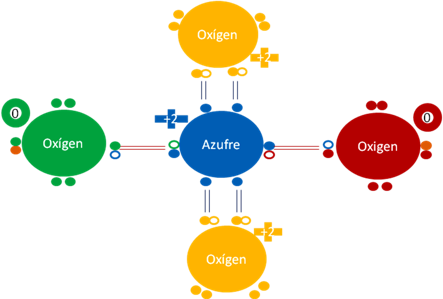
Ión sulfato donde los dos pares de barras de color rojo representan a dos enlaces covalentes ordinarios en que los átomos de cada enlace comparten dos electrones y dos huecos. Los 4 pares de barras de color azul oscuro representan a los 4 enlaces hipervalentes donde los átomos en cada enlace comparten a dos electrones pero un solo hueco. Los pequeños círculos rellenos de distintos colores representan a los electrones de los átomos que tienen su mismo color. Los pequeños círculos vacíos representan a los huecos de los átomos que tienen el mismo color de línea.
Figura No.6.
ÁTOMO de NITRÓGENO y FÓSFORO en ESTADO FUNDAMENTAL y EXCITADO.
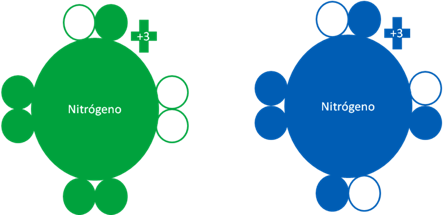
Átomos de Nitrógeno donde el átomo de la izquierda corresponde a un átomo de nitrógeno fundamental mientras el nitrógeno de la derecha, es un átomo en estado excitado. Los pequeños círculos rellenos de verde y azul corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.6.
ANIÓN FOSFATO PO4-3.
El anión fosfato es una sal o ester del ácido fosfórico que se encuentra formado por 3 oxígenos unidos de forma covalente al fósforo. La carga eléctrica de los 3 oxígenos distintos al hipervalentes es cero (0) pero son relativamente negativos con respecto al fósforo. Estos tres oxígenos tienen en la figura un electrón adicional representado por un círculo pequeño relleno de color naranja oscuro que se los dejo el enlace iónico del hidrógeno.
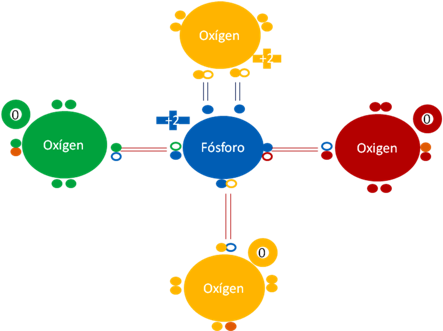
Ión fosfato donde los 3 pares de barras de color rojo representan a tres enlaces covalentes ordinarios en que los átomos de cada enlace comparten dos electrones y dos huecos. Los dos pares de barras de color azul oscuro representan a dos enlaces hipervalentes donde los átomos comparten en cada enlace dos electrones y un solo hueco. Los pequeños círculos rellenos de distintos colores representan a los electrones de los átomos que tienen su mismo color. Los pequeños círculos vacíos representan a los huecos de los átomos que tienen el mismo color de línea.
Figura. No. 7.
PENTAÓXIDO de DINITRÓGENO N2O5.
En el pentaóxido de dinitrógeno, cada átomo de nitrógeno es hipervalente, tiene 5 enlaces y 3 de ellos, son enlaces covalentes ordinarios y dos son hipervalentes.
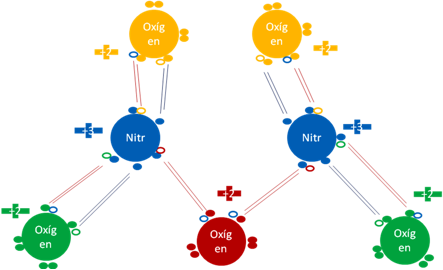
Pentaóxido de dinitrógeno. Los 6 pares de barras de color rojo representan a los 6 enlaces covalentes ordinarios de dos electrones y dos huecos. Los 4 pares de barras de color azul oscuro representan a los 4 enlaces hipervalentes. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.8.
TETRAÓXIDO DE DINITRÓGENO N2O4.
Si al pentaóxído de dinitrógeno se le elimina el oxígeno central entonces queda el tetraóxido de dinitrógeno y siguen siendo hipervalentes los dos átomos de nitrógeno.
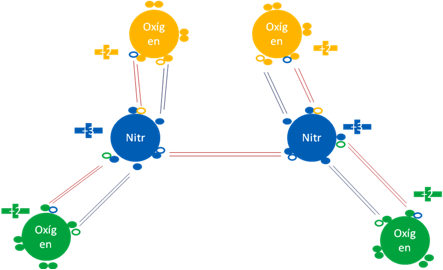
Tetraóxido de dinitrógeno. Los 5 pares de barras de color rojo representan a los 5 enlaces covalentes ordinarios de dos electrones y dos huecos. Los 4 pares de barras de color azul oscuro representan a los 4 enlaces hipervalentes. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.9.
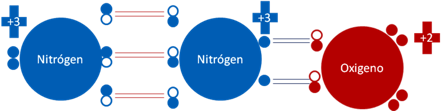
DIOXIDO de NITRÓGENO NO2.
Como el tetraóxido de dinitrógeno N2O4, es un dímero del NO2, por esa razón mencionamos al dióxido de nitrógeno, no porque sea una molécula hipervalente sino por su origen y que sufre el fenómeno de la resonancia.
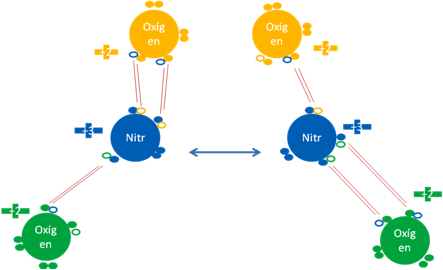
Dióxido de nitrógeno. Todos los pares de barras son de color rojo y representan a los enlaces covalentes ordinarios de dos electrones y dos huecos. La flecha central con doble asta de color azul indica la resonancia de la molécula de dióxido de nitrógeno. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Fig. No.10.
Cuando se rompe el enlace central que une a los dos nitrógenos del tetraóxido dinitrógeno N2O4, debido al electrón enlazante que le queda a cada nitrógeno, se vuelve inestable y no puede soportar a los dos enlaces hipervalentes, enseguida los rompe, con el electrón que le queda de cada enlace hipervalente conforma un par de electrones libres, con el electrón enlazante que le queda configura la resonancia.
TRIÓXIDO de DINITRÓGENO N2O3.
Si al tetraóxido de dinitrógeno se le elimina uno de los 4 oxígenos, entonces queda el trióxido de dinitrógeno pero, al nitrógeno que pierde el oxígeno, deja de ser un átomo hipervalente y le quedan desocupados un par de electrones y un hueco por lo tanto, el guarda al par de electrones apareados y con el oxígeno que le resta, conforma un doble enlace covalente ordinario:
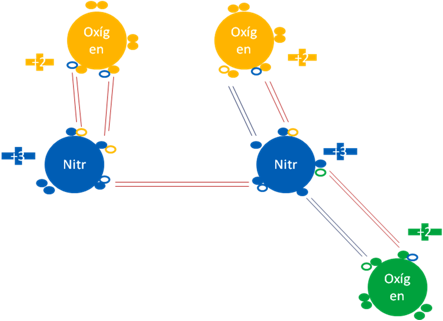
Trióxido de dinitrógeno. Los 5 pares de barras de color rojo representan a los 5 enlaces covalentes ordinarios de dos electrones y dos huecos. Los dos pares de barras de color azul oscuro representan a los dos enlaces hipervalentes. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.11.
El nitrógeno de la izquierda en la anterior figura, no es hipervalente pero el de la derecha sí continúa siéndolo.
ÁCIDO NÍTRICO HNO3.
Si al trióxido de dinitrógeno le eliminaos el nitrógeno no hipervalente, entonces el oxígeno se conecta directamente con el nitrógeno hipervalente y forma al Ácido nítrico.
Ácido nítrico. Los 4 pares de barras de color rojo representan a los 4 enlaces covalentes ordinarios de dos electrones y dos huecos. Los dos pares de barras de color azul oscuro representan a los dos enlaces hipervalentes del átomo de nitrógeno central. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.12.
ANIÓN NITRATO NO3-1.
Si el átomo de hidrógeno deja iónicamente el electrón en el oxígeno terminal del ácido nítrico, queda de la siguiente manera el catión H+ más el anión nitrato NO3-1.
Catión hidrógeno + el anión Nitrato. Los 3 pares de barras de color rojo representan a los 3 enlaces covalentes ordinarios de dos electrones y dos huecos. Los dos pares de barras de color azul oscuro representan a los dos enlaces hipervalentes. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.13.
El oxígeno del nitrato ubicado en el extremo izquierdo de la anterior figura, tienen 7 electrones, le quitó iónicamente el electrón del hidrógeno que lo tenía en el ácido nítrico.
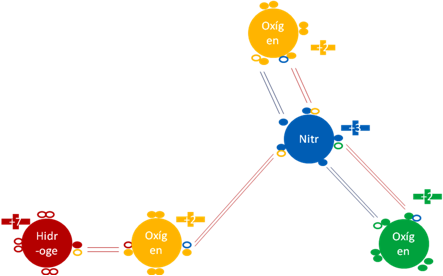
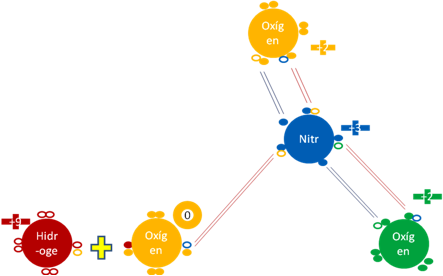
MONÓXIDO de DINITRÓGENO N2O.
El monóxido de dinitrógeno es una molécula con dos enlaces hipervalentes y 3 enlaces covalentes ordinarios.
Monóxido de dinitrógeno. Los 3 pares de barras horizontales de color rojo representan a los 3 enlaces covalentes ordinarios de 2 electrones y dos huecos. Los 2 pares de barras horizontales de color azul oscuro representan a dos enlaces hipervalentes de dos electrones y un hueco. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.14.
ÁCIDO HIDRAZOICO HN3.
La azida de hidrógeno o nitruro de hidrógeno está formado por la unión de tres átomos de nitrógeno.
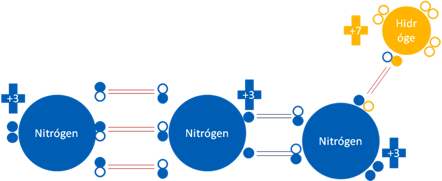
Ácido hidrazoico HN3. Los 4 pares de barras de color rojo representan a los 4 enlaces covalentes ordinarios de dos electrones y dos huecos. Los dos pares de barras de color azul oscuro representan a los dos enlaces hipervalentes de dos electrones y un hueco. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.15.
AZIDA N3-1.
La azida es un anión quien es la base conjugada del acido hirazoico:
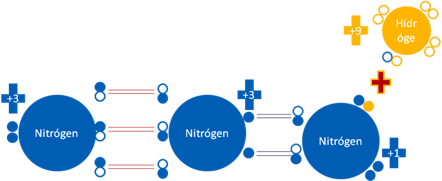
Azida N3-1 que es la base conjugada del ácido hidrazoico. Los 3 pares de barras de color rojo representan a los 3 enlaces covalentes ordinarios de dos electrones y dos huecos. Los dos pares de barras de color azul oscuro representan a los dos enlaces hipervalentes de dos electrones y un hueco. Los pequeños círculos rellenos de distintos colores corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Figura No.14.
El nitrógeno del extremo derecho de la azida en la anterior figura, tiene 6 electrones, le quitó iónicamente ese electrón al hidrógeno que lo tenía en el ácido hidrazoico.
3- Conclusiones:
1- LA PRIMERA GRAN CONCLUSIÓN de este artículo es que en realidad, los huecos revolucionan a la fisicoquímica, por las grandes repercusiones que tiene en la carga eléctrica de los átomos en las moléculas. Si bien es cierto que este artículo es solo teoría y que hace falta sobretodo probar en unos semiconductores propuesto en el trabajo de células fotoeléctricas. Además hay fenómenos indiscutibles, como son la identificación de dos tipos de enlaces covalentes en las moléculas hipervalentes, la descripción de los iones divalentes de plomo, etc., etc. Es probable también que el hueco como partícula, explique las anomalías en la configuración electrónica que tienen los elementos de transición.
2- LA SEGUNDA GRAN CONCLUSIÓN de este trabajo es la confirmación de la “Nueva regla del octeto” quien sostiene que todos los átomos, están rodeados por su capa de valencia que está conformada por 8 partículas, esas partículas están constituidas por electrones y huecos.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[1] Nueva regla del octeto
[2] Estado fundamental del átomo
[3] Estado fundamental del átomo
[4] Barrera rotacional del etano.
[5] Enlaces de uno y tres electrones.
[6] Enlaces de uno y tres electrones.
[7] Origen de la barrera rotacional del etano
[8] Monóxido de Carbono
[9] Nueva regla fisicoquímica del octeto
[10]Células fotoeléctricas Monografías.
[11]Células Fotoeléctricas textoscientificos.
[12]Semiconductores Monografías.
[13]Semiconductores textoscientificos.
[14]Superconductividad.
[15]Superconductividad.
[16]Alotropía.
[17]Alotropía del Carbono.
[18]Alotropía del Oxigeno.
[19]Ozono.
[20]Diborano
[21]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 05 de Septiembre del 2013 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.