Aunque el etilenglicol se conocía desde 1859 (Wurtz), el mismo no se produjo industrialmente hasta la Primera Guerra Mundial. Su síntesis se basa en la hidrólisis de óxido de etileno producido por el proceso de clorhidrina. La producción a partir de formaldehído y monóxido de carbono también se utilizó comercialmente entre 1940-1963. Sin embargo ninguno de estos métodos se utiliza actualmente. La oxidación directa de etileno a etilenglicol también fue empleada comercialmente durante un corto tiempo, pero fue abandonada, probablemente debido a los problemas causados por la corrosión.
Hidrólisis de Óxido de Etileno
Método de producción actual
Actualmente sólo se utiliza un método para la producción industrial de etilenglicol. Este método se basa en la hidrólisis de óxido de etileno obtenido por oxidación directa de etileno con aire o con oxígeno. El óxido de etileno se hidroliza térmicamente a etilenglicol sin un catalizador. La Figura 1 muestra un esquema simplificado de una planta de producción de etilenglicol por este método. La mezcla óxido de etileno - agua se precalienta a alrededor de 200 ºC, por lo que el óxido de etileno se convierte en etilenglicol. También se producen di-, tri- y tetra- glicoles de polietileno, pero con rendimientos decrecientes respectivamente.
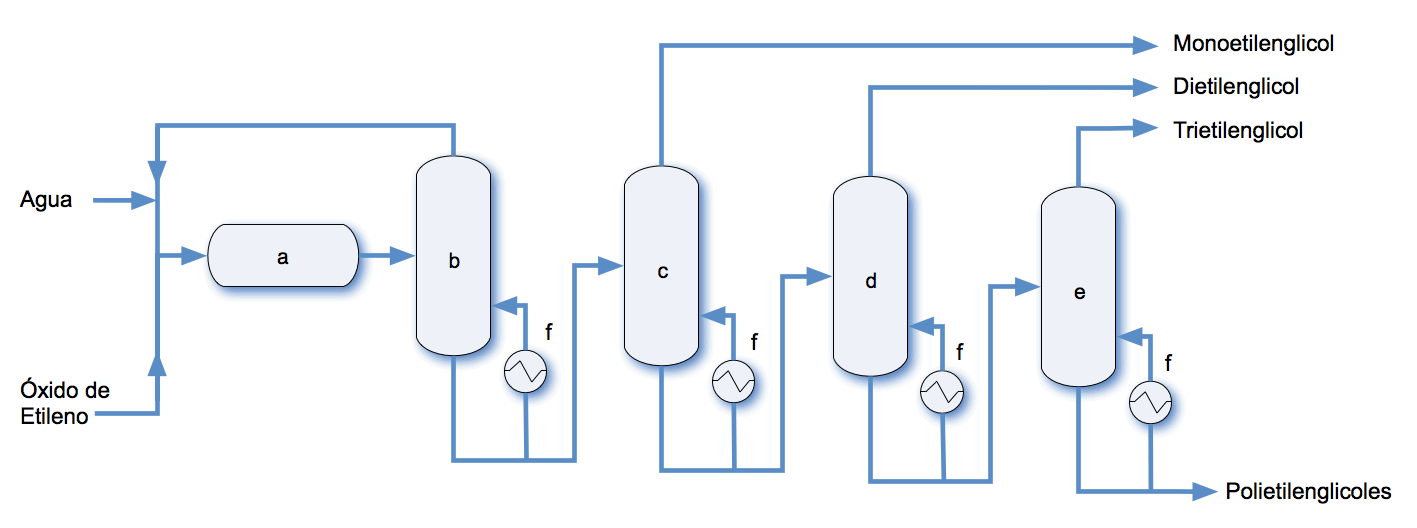
a) Reactor; b) la columna de secado; c) columna monoetilenglicol; d) columna de dietilenglicol; e) columna de trietilenglicol; f) intercambiador de calor.
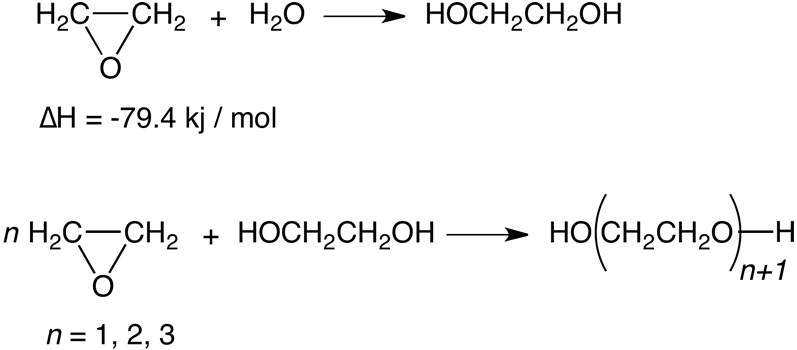
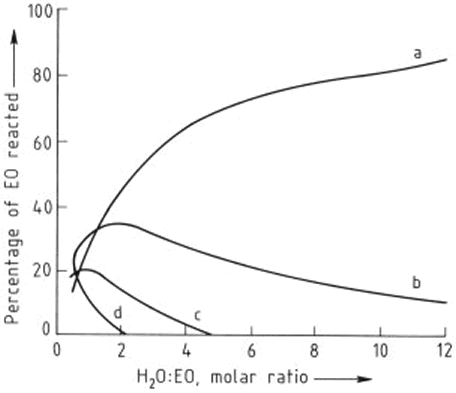
La formación de estos homólogos superiores es inevitable porque el óxido de etileno reacciona con los etilenglicoles con más rapidez que con el agua; sin embargo, sus rendimientos pueden reducirse al mínimo si se utiliza un exceso de agua - normalmente se emplea un exceso molar de 20 veces. La Figura 2 muestra la composición de la mezcla de producto resultante como una función de la relación de agua / óxido de etileno. Aunque los valores se determinaron mediante el uso de ácido sulfúrico como catalizador, también se aplican como una buena aproximación para la reacción sin catalizador. Por lo tanto, en la práctica casi el 90% del óxido de etileno se puede convertir en monoetilenglicol, el 10% restante reacciona para formar homólogos superiores:
a) monoetilenglicol; b) dietilenglicol; c) Trietilenglicol; d) polietilenglicoles mayores.
Después de dejar el reactor, la mezcla producto se purifica pasándolo a través de sucesivas columnas de destilación con presiones decrecientes. El agua se elimina primero y regresa al reactor, los mono-, di-, y tri- etilenglicoles se separan luego por destilación al vacío. El rendimiento de tetraetilenglicol es demasiado bajo para justificar su aislamiento por separado. El calor liberado en el reactor se utiliza para calentar las columnas de destilación. Se debe proporcionar una corriente lateral para evitar la acumulación de productos secundarios, especialmente las pequeñas cantidades de aldehídos, que se producen durante la hidrólisis. La forma del reactor afecta a la selectividad de la reacción. Los reactores de flujo pistón son superiores a tanto a los de tanque agitado y reactores de columna.
Posibles Mejoras y Desarrollos
El método de producción de glicol planteado anteriormente es el único con una importancia industrial en la actualidad. Es un método simple, pero tiene algunos inconvenientes importantes:
- La selectividad de la primera etapa - la producción de óxido de etileno - es baja (alrededor de 80%).
- La selectividad de la hidrólisis de óxido de etileno es baja - alrededor de 10% se convierte en di- y tri- etilenglicol.
- El consumo de energía para la destilación de la gran cantidad de agua en exceso es alta.
Por lo tanto, se ha llevado a cabo mucha investigación para mejorar este proceso. La búsqueda de mejores catalizadores de plata es un objetivo para el punto 1. Los puntos 2 y 3 deben ser considerados juntos, ya que una mayor selectividad para la hidrólisis de óxido de etileno reduce automáticamente el exceso de agua requerida.
Se han descrito muchos catalizadores en la literatura que son capaces de optimizar la selectividad o reducir la temperatura de reacción y el exceso de agua requerida. Se sabe que los ácidos y bases aceleran la velocidad de reacción. La cinética de la catálisis con ácidos y bases de la hidrólisis de óxido de etileno se han investigado a fondo. La viabilidad industrial de la catálisis con columnas de intercambio iónico en fase líquida y fase gaseosa ha sido probada. Aunque el uso de catalizadores permite bajar la temperatura de reacción, la selectividad no fue significativamente mayor. Además, el catalizador necesita ser separado y luego, o bien ser devuelto a la mezcla de reacción o ser reemplazado. Como resultado de estos inconvenientes, estos tipos de catálisis no han demostrado ser de uso comercial. Sin embargo, varios catalizadores que mejoran la selectividad han sido descritos en patentes; entre estos se incluyen molibdatos, vanadatos, intercambiadores de iones, y compuestos orgánicos de antimonio. Sin embargo, sus ventajas todavía no parecen justificar su utilización a escala industrial.
La síntesis selectiva de etilenglicol usando como intermediario el carbonato de etileno (1,3-dioxolan-2-ona) parece ser una alternativa prometedora. Este compuesto se obtiene con alto rendimiento (98%) por reacción de óxido de etileno con dióxido de carbono y se puede hidrolizar selectivamente para dar un alto rendimiento de etilenglicol. Sólo se requiere el doble de la cantidad molar de agua para esta reacción.
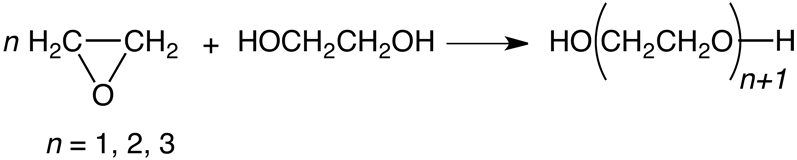
De acuerdo con una patente de Halcon Sd Group Inc de 1983, el oxido de etileno se puede extraer de la solución acuosa formada durante su producción con dióxido de carbono supercrítico. Se obtiene la solución de oxido de etileno - dióxido de carbono, que reacciona para formar carbonato de etileno. La hidrólisis del carbonato de etileno produce entonces etilenglicol. Algunos de los posibles catalizadores para esta reacción son las sales de amonio y fosfonio cuaternario, tales como R4NHal, R4PHal, o Ph3PCH3I. Todavía deben resolverse problemas tales como la separación del producto y la retroalimentación del catalizador, pero este método para la síntesis selectiva de etilenglicol a partir de óxido de etileno parece ser el más prometedor para su aplicación a escala industrial.
Métodos Alternativos para la Producción de etilenglicol
La baja selectividad de la producción de óxido de etileno y el aumento de los precios del etileno garantizan la búsqueda de formas alternativas de producir etilenglicol.
Oxidación directa de etileno
Como se mencionó anteriormente, la oxidación catalítica de etileno con oxígeno en ácido acético ya se ha utilizado a escala industrial, pero este método pronto fue abandonado debido a los problemas causados por la corrosión. El rendimiento de etilenglicol (> 90%) fue mucho mayor que el obtenido en la ruta más indirecta a través de óxido de etileno.
Un sistema catalizador recientemente desarrollado se basa en el uso de paladio (II), Pd (II). Se ha demostrado que una mezcla de PdCl2, LiCl, y NaNO3 en ácido acético y anhídrido acético da una selectividad del 95% para la formación de monoacetato de glicol y diacetato de glicol (60 - 100 ºC, 3.04MPa). Durante este proceso, el Pd (II) se reduce a Pd (0). Se evita la precipitación de Pd (0), ya que se vuelve a oxidar a Pd (II) por los iones nitrato. El oxígeno disponible finalmente regenera el nitrato, proporcionando así un sistema catalítico completo.
La formación de monoacetato de etilenglicol (50% de rendimiento) y diacetato de etilenglicol (7% de rendimiento) también ha sido investigada utilizando el sistema de catalizador PdCl - NO2 - CH3CN disuelto en ácido acético ácido. Los estudios con isótopos radiactivos mostraron que el NO2 funciona como un agente oxidante. El acetato de vinilo se forma como un subproducto (rendimiento 20%). Sin embargo, la acción catalítica de este sistema es agota rápidamente debido a la precipitación de compuestos de paladio.
Si se utiliza un sistema PdCl2 - CuCl2 - CuOCOCH3, la reacción se produce en condiciones suaves (65 ºC, 0,5 MPa), sin la formación de un precipitado y se obtiene un rendimiento de más del 90%.
En los últimos años se ha prestado cada vez más atención a los sistemas de Pd (II) como catalizadores para la oxidación directa de etileno a etilenglicol. A pesar del gran interés en esta alternativa, aún no se han realizado aplicaciones industriales.
Síntesis desde Unidades C1
La escasez a largo plazo y el aumento del precio del petróleo crudo han llevado a una intensa búsqueda de métodos de producción de productos orgánicos intermedios a partir de unidades C1 (es decir, métodos basados en el carbón). Han aparecido muchas publicaciones sobre la síntesis de etilenglicol por este enfoque. Sólo se discuten aquí los métodos más importantes que se basan en gas de síntesis o el monóxido de carbono.
A alta presión, el monóxido de carbono y el hidrógeno reaccionan directamente para producir etilenglicol Sin embargo, la reacción es lenta y el catalizador es sensible y caro. Otros métodos implican la formación de formaldehído, metanol, o ésteres de ácido oxálico como compuestos intermedios. El único método con el potencial para alcanzar importancia industrial era la empleadp por Du Pont entre 1940 y 1963, el cual utiliza el formaldehído y el ácido glicólico como productos intermedios. Sin embargo se requiere alta presión y temperatura, (48 MPa, 220 ºC). Este proceso se mejoró significativamente con la introducción de fluoruro de hidrógeno como catalizador (1 - 2 MPa, 60 ºC).
En la actualidad, ninguno de los métodos basados en unidades de C1 descritos puede competir con la ruta etileno → óxido de etileno → etilenglicol. Sin embargo, si los precios del petróleo crudo aumentan, la síntesis de glicol de etileno a partir de unidades de C1 sería más atractivo económicamente.