Combinaciones binarias con los no metales: el sulfuro de hidrógeno
El H2S es un gas que se quema con una llama azul. Es poco soluble en agua y tiene un olor característico definido como olor a huevos podridos (resultado de la descomposición anaerobia de las proteínas que contienen azufre) Está presente en los depósitos de gas natural como consecuencia de la fermentación de materia orgánica en condiciones anaerobias. Es uno de los responsables del mal olor de las aguas estancadas o de los cadáveres en estado de putrefacción. El H2S mantiene una cierta analogía estructural con el H2O, pero es mucho menos estable (el enlace S-H es más débil que el O-H).
H2S |
H2O |
|
|---|---|---|
| Long. enlace E–H (pm) | 133,6 |
95,7 |
| Ángulo enlace H–E–H | 92,1 |
104,5 |
| P. fusión (ºC) | -85,6 |
0 |
| P. ebullición (ºC) | -60,3 |
100 |
| pKa: H2E(ac) → HE- + H+ (ac) | 6,9 |
14 |
Es extremadamente tóxico (comparable a la toxicidad del HCN). A pesar de ser incoloro, es fácilmente detectable por su olor.
Preparación en el laboratorio
A partir de la hidrólisis de sulfuros metálicos:
FeS(s) + 2 HCl(ac) → FeCl2(ac) + H2S (g)
Un producto más puro se puede obtener por hidrólisis del Al2S3:
Al2S3 + 2 H2O → Al(OH)3 + 3 H2S
Reactividad
Es un buen reductor pudiéndose oxidar a S elemental o a SO2 dependiendo de las condiciones:
defecto de O2: 2 H2S(g) + O2 (g) → 2 H2O(l) + 2 S (s)
exceso de O2: 2 H2S(g) + 3 O2 (g) → 2 H2O(l) + 2 SO2 (s)
En disolución es oxidado a azufre por casi todos los agentes oxidantes:
H2S(g) → 2 H+(ac) + S (s) + 2e-; Eº(S/H2S) = +0,14V
Dada su toxicidad es conveniente eliminarlo del gas natural y otros combustibles fósiles antes de su utilización. Uno de los métodos es la reacción con NaOH:
H2S (g) + 2 NaOH (ac) → Na2S (s) + 2 H2O (l)
A pesar de su toxicidad, se ha utilizado el H2S para el análisis cualitativo de mezclas de cationes metálicos. El método se basa en la dependencia con el pH de la solubilidad de los sulfuros metálicos. Así al pasar sulfuro de hidrógeno a través de una disolución que contenga distintas sales se produce la precipitación fraccionada de grupos de iones según el valor de pH (pH<1 sulfuros más insolubles: PbS, CuS, HgS (Kps<10-28); pH neutro o débilmente alcalino ZnS, MnS, FeS, NiS (10-15>Kps>10-22))
Combinaciones binarias con los metales: los sulfuros metálicos
La mayoría de los metales reacciona directamente con azufre formando combinaciones binarias no moleculares llamadas genéricamente sulfuros. El anión sulfuro es más grande y por tanto más polarizable que el anión oxido. Por ello las redes cristalinas de los sulfuros son generalmente más covalentes que las de los óxidos análogos lo cual hace que presenten pocas analogías entre ellos. La mayoría de los sulfuros metálicos no pueden describirse adecuadamente si se supone que son fundamentalmente iónicos. Los sulfuros metálicos tienen mayor tendencia a la covalencia que los óxidos. Frecuentemente su estequiometría es peculiar, a menudo se trata de fases no estequiométricas de compuestos en el sentido clásico y también es común que sean polimórficos (ej ZnS puede adoptar las estructuras de blenda y wurtzita). El ión S2- es mejor reductor que O2-, por ello los sulfuros presentan bandas de transferencia de carga a más baja energía y son coloreados, oscuros o incluso negros. Las bandas de transferencia implican la absorción de la luz visible que se utiliza para promover una transición electrónica de un orbital fundamentalmente del anión a otro fundamentalmente del metal. En el caso de los óxidos, el orbital del anión está a más baja energía (O es más electronegativo) y la transición requiere un fotón de más energía. Esta transición que en los óxidos tiene lugar en el UV, aparece en los sulfuros en la zona del visible y por ello son más coloreados (Ej. HgS, cinabrio, rojo).
Los sulfuros de los grupos 1, 2, (y tambien Al, Cr y tierras raras) forman los sulfuros de mayor carácter iónico, y donde puede identificarse al ión sulfuro, S2-. Cristalizan en retículos iónicos simples (antifluorita para lo alcalinos y NaCl para los alcalinotérreos). Estos sulfuros iónicos son los únicos solubles. Realmente se hidrolizan en agua y, como consecuencia de ello, sus disoluciones son fuertemente básicas:
S2-(ac) + H2O ↔ SH-(ac) + OH-(ac)
La acidificación de tales disoluciones da lugar al sulfuro de hidrógeno (con el consiguiente mal olor):
SH-(ac) + H2O ↔ H2S(ac) ↔ H2S(g)
A medida que el metal es menos electropositivo aumenta el grado de hidrólisis. Así la hidrólisis del sulfuro de sodio en medio acuoso es parcial (el hidróxido formado permanece en la disolución e impide que la hidrólisis progrese) Se produce el equilibrio:
Na2S + 2 H2O ↔ H2S (ac) + 2 NaOH (ac)
Sin embargo el sulfuro de aluminio se hidroliza completamente. La precipitación del hidróxido de aluminio ayuda a desplazar el equilibrio.
Al2S3 + H2O ↔ H2S (ac) + Al(OH)3 (s) (o Al2O3.xH2O(s))
Entre las aplicaciones tecnológicas más relevantes de estos sulfuros destaca la utilización del sistema Na/S (y tambien el Li/S) en la fabricación de baterías de alto rendimiento. En esta batería ambos electrodos son líquidos (Na(ánodo) y S(cátodo) fundidos), mientras que el electrolito NaAl11O17 es un sólido. Los procesos que se dan en los electrodos son:
Ánodo: Na (l) → Na+ + e-
Cátodo: n S (l) + 2e- → Sn-2
el proceso global es:
2 Na + n/8 S8 → Na2Sn; E° = 2.08V
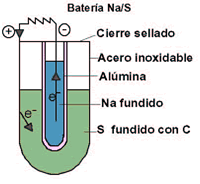
Un tubo cerámico, construido con el electrolito sólido (b-alúmina),
separa el depósito interno de sodio fundido (Tf = 98 ºC) de un baño externo de S fundido (Tf = 119ºC) al tiempo que permite que los cationes Na+ pasen a su
través. El sistema está sellado e introducido en una cápsula de acero que sirve
como colector de la corriente generada. En el azufre fundido se pone algo de
grafito para facilitar la conducción eléctrica. Este tipo de batería almacena 5
veces más de energía que la de Pb y puede ser recargada con relativa rapidez
(15-20 h) lo que la hace una buena candidata para equipar vehículos a motor.
Una batería para automóvil puede contener 980 de estas celdas (380 mm x 28 mm de diámetro cada una) que dan un voltaje de 199 V. Uno de los inconvenientes es que
debe trabajar a alta temperatura
(300 ºC)
Otras aplicaciones relevantes de los sulfuros metálicos.
- Na2S se emplea en el proceso de curtido de pieles (para eliminar los pelos)
- SeS2 como aditivo en champú anticaspa.
- MoS2 es un excelente lubricante para superficies metálicas.
- CdS se emplea como pigmento amarillo brillante para pinturas al óleo.