De entre los óxidos de azufre (se han encontrado más de una docena), el dióxido de azufre, SO2, y el trióxido de azufre, SO3, son los más importantes.
El dióxido de azufre es el óxido más común y uno de los más importantes. Es un gas incoloro, denso, de olor intenso, tóxico (máximo tolerado por los humanos 5 ppm y para los vegetales 1 ppm).
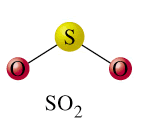
Estructura molecular
Angular (119º), híbridos sp2. El enlace S–O está reforzado por la posibilidad de retrodonación dp-pp. La distancia S–O (1.431Å) es intermedia entre la de un enlace sencillo y uno doble.
Es un compuesto muy soluble en agua (39 cc de gas en 1 cc de agua), aunque no se ha detectado la formación del ácido sulfuroso aunque sí existen sus correspondientes sales (sulfitos y bisulfitos).
SO2(g) + H2O(l) → ¿H2SO3(ac)?
Tiene propiedades reductoras lo que justifica su capacidad para actual como agente blanqueador.
Medio ácido: Eo(SO42-/SO2 ) = 0.2V.
Medio básico: Eo(SO42-/SO32) = -0.90V (más reductor en medio básico)
A escala industrial se obtiene mediante dos métodos, la combustión directa de azufre o sulfuro de hidrógeno y la tostación de sulfuros de metales.
1/8S8(s) + O2(g) → SO2(g)
2 ZnS(s) + 3O2(g) → 2 ZnO(s) + 2 SO2(g)
A pequeña escala puede obtenerse haciendo reaccionar ácido sulfúrico con sulfito sódico:
H2SO4 (ac) + Na2SO3 (s) → SO2 (g) + Na2SO4 (ac) + H2O (l)
La principal aplicación del SO2 es la síntesis de SO3 para obtener ácido sulfúrico, H2SO4.
SO2(g) + ½ O2(g) → SO3(g) ΔH = -98kJ/mol
El SO2 también se emplea en la industria del papel y la pulpa de madera como blanqueador. Otro de sus usos más destacados es como aditivo en vinos. El SO2 se usa como antioxidante y para prevenir el oscurecimiento en vinos, patatas deshidratadas y otros. El SO2 parece ser inocuo cuando se ingiere con los alimentos, sin embargo es muy irritante para las vías respiratorias cuando se inhala. Su utilización en la fabricación de vinos tiene los siguientes efectos: evitar el crecimiento de levaduras, que se encuentran en la piel de las uvas y que estropearían el vino, se combina con el acetaldehido, una sustancia que puede afectar al sabor del vino y, por último, sirve como antioxidante para prevenir la oxidación del alcohol etílico a ácido acético (vinagre).
El trióxido de azufre, SO3 es también un gas (Peb: 44.8 ºC, Pf: 17 ºC).
Estructura molecular
En fase gasososa consta de moléculas triangulares planas, con un ángulo O-S-O de 120º.
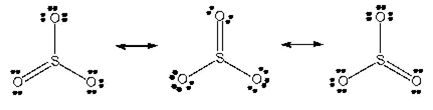
En fase líquida se presenta como una mezcla en equilibrio de esas moléculas y el trímero cíclico (SO3)3.
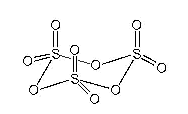
Es un compuesto muy reactivo (como lo muestra su tendencia a polimerizarse). Se disuelve en agua con reacción violenta que da disoluciones de ácido sulfúrico. Es un agente oxidante poderoso y un ácido de Lewis más duro y fuerte que el SO2. La obtención del SO3 está basada en la reacción anteriormente citada. Esta reacción es termodinámicamente favorable pero extremadamente lenta en ausencia de catalizadores:
SO2 + 1/2 O2 → SO3 ΔH = -98 kJ mol-1
El problema medioambiental de los óxidos de azufre
La contaminación industrial consiste principalmente en partículas (cenizas y humo), SO2(g) y niebla de H2SO4. Muchas operaciones industriales producen cantidades importantes de SO2(g). Sin embargo, los principales responsables de los escapes de SO2(g) son las plantas térmicas de carbón y los combustibles de alto contenido de azufre. El SO2(g), como hemos visto, puede oxidarse a SO3(g), especialmente cuando la reacción se cataliza sobre las superficies de las partículas en suspensión en el aire o mediante la reacción con NO2(g):
SO2(g) + NO2(g) → SO3(g) + NO(g)
A su vez el SO3(g) puede reaccionar con vapor de agua de la atmósfera obteniéndose niebla de H2SO4, un componente de la lluvia ácida (el pH de la lluvia ácida es de 4,3 mientras que el pH de la lluvia normal es de 5,5). La lluvia ácida tiene una incidencia relevante en las aguas superficiales, especialmente en los lagos puesto que puede llegar a alterar su pH. También afecta considerablemente a los bosques. Ataca a los edificios construidos con piedra caliza debido a que el H2SO4 reacciona con el CaCO3 componente de aquellas y de los mármoles:
CaCO3 (s) + H2SO4 (ac) → CaSO4 (s) + H2O (l) + CO2 (g)
Por otra parte, la reacción de H2SO4 con el NH3 del aire produce partículas de (NH4)2SO4. Los detalles del efecto en el organismo humano de concentraciones bajas de SO2 y H2SO4 no se conocen del todo, pero está claro que estas sustancias irritan el sistema respiratorio. Niveles superiores a 0.10 ppm se consideran nocivos potencialmente.
Por todo ello, la minimización de la generación de óxidos de azufre es un problema medioambiental serio. Las medidas para reducir las emisiones de SO2(g) y NO(g) incluyen la utilización de combustibles de bajo contenido de azufre, el control de las temperaturas de combustión para reducir las emisiones de NO(g) e impedir la emisión de gases de escape no permitidos, por diferentes medios. Un método prometedor para el control de la contaminación es la combustión en lecho fluidizado. Se introduce carbón en polvo, piedra caliza y aire en una cámara de combustión donde el agua que circula por un serpentín se convierte en vapor. La combustión se lleva a cabo a una temperatura relativamente baja (760-870 ºC), que minimiza la producción de NO(g) a partir de N2(g) y O2(g) en el aire. Al mismo tiempo, el SO2(g) formado a partir del azufre que lleva el carbón, es retenido con el CaO(s) para formar CaSO3(s) según la reacción:
CaO(s) + SO2(g) → CaSO3(s)
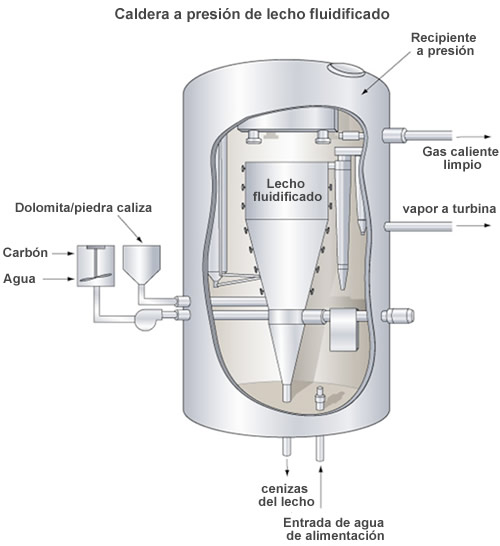
El SO2 que no reacciona en esta primera etapa se elimina en una segunda en la que los gases de combustión se hacen pasar por una cámara de purificación donde se les rocía con una suspensión acuosa de CaO. El resultado final es un vapor que contiene fundamentalmente H2O y CO2.