Basándonos sólo en la configuración electrónica, es de esperar que el oxígeno y el azufre sean parecidos. Ambos elementos forman compuestos iónicos con metales activos y compuestos covalentes similares como H2S y H2O, CS2 y CO2, SCl2 y Cl2O. Aún así existen diferencias importantes entre los compuestos de oxígeno y azufre. Por ejemplo, el H2O tiene un punto de ebullición muy alto (100 ºC) para ser un compuesto de masa molecular tan baja (18 u), mientras que el punto de ebullición de H2S (masa molecular 34 u) es más normal (-61 ºC).
Compuestos de oxígeno y sus análogos de azufre
| Na2O (óxido de sodio) | Na2S (sulfuro de sodio) |
| H2O (agua) | H2S (sulfuro de hidrógeno) |
| O3 (ozono) | SO2 (dióxido de azufre) |
| CO2 (dióxido de carbono) | CS2 (disulfuro de carbono) |
| OCN−(ión cianato) | SCN− (ión tiocianato) |
| OC(NH2)2 (urea) | SC(NH2)2 (tiourea) |
En general, las diferencias con el elemento más ligero de su grupo pueden atribuirse a las siguientes características
- Pequeño tamaño del oxígeno
- Menor electronegatividad del azufre (2.5) que la del oxigeno (3.5).
- Presencia de orbitales d de baja energía en la capa de valencia del S
Efecto de la diferencia de tamaño entre O y S
El tamaño del azufre es un 60% mayor que el del oxígeno. En consecuencia, resulta más difícil para el azufre formar enlaces doble S=S tan fuertes como los que forma el oxígeno. No obstante existen compuestos que presentan enlaces dobles S=O y S=C como el SO2 y el CS2. Pero estos enlaces dobles son más débiles que los equivalentes con oxígeno encontrados en las moléculas análogas de O3 y CO2. Por ejemplo, la energía de disociación del enlace C=O en el CO2 es 745 kJ/mol mientras que la energía de disociación del enlace C=S en el CS2 es de sólo 477 kJ/mol.
Por otra parte, el enlace sencillo S-S es extraordinariamente fuerte (270 kJmol-1) comparado con el O-O (145 kJmol-1). Esto se traduce en la enorme tendencia a la catenación, o formación de compuestos con cadenas de enlaces S-S. En este sentido, el azufre es el elemento que sigue al carbono en su capacidad para formar compuestos con enlaces sencillos X–X–X extendidos; en otras palabras es el segundo elemento en cuanto a su tendencia a la homocatenación. Cuando se habla de alotropismo se suelen confundir dos conceptos de naturaleza diferente:
Polimorfos: diferentes formas cristalinas de un mismo compuesto cuyas unidades estructurales se empaquetan de forma diferente. El azufre puede producir cristales monoclínicos de color amarillo intenso (cuya forma recuerda en sus extremos la hoja de un formón) o rómbicos de color ámbar (cristales cuya forma es la de un paralepípedo).
Alótropos: diferentes formas de un mismo elemento en el cual los enlaces químicos entre los átomos son diferentes y por tanto que dan lugar a unidades moleculares también diferentes. En el caso del azufre, se conocen un número considerable de alótropos algunos de los cuales se presentan en la figura siguiente:
La unidad de azufre (alótropo) más conocida es el anillo de S8. Esta es la forma predominante en el azufre vapor y el constituyente de las dos formas sólidas (polimorfos) comunes, el azufre rómbico (α-S8, r = 2.069 gcm-3) y el azufre monoclínico (β-S8, r = 1.94 gcm-3).
Sromb ↔ Smonoc ΔH = 0.45 kJ mol-1
El azufre rómbico, la forma más estable a baja temperatura, se transforma en azufre monoclínico a 95.5 ºC y el azufre monoclínico funde a 119 ºC. La unidad molecular en ambos polimorfos es el anillo de ocho miembros S8 que tiene una conformación de bote. La transformación rómbico ↔ monoclínico consiste, por tanto, en un cambio de estructura cristalina, sin modificación en la constitución molecular. Esta pequeña transformación justifica una entalpía de transformación tan baja.
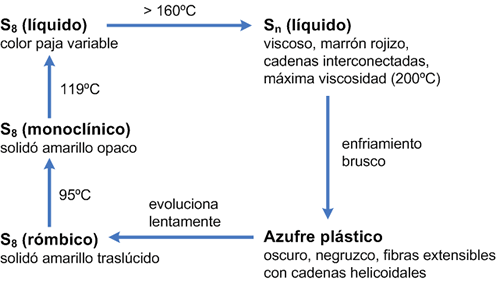
El azufre empieza a fundir a unos 119 ºC. A pesar de esta baja temperatura de fusión, el proceso es lento debido a que el azufre es un pésimo conductor del calor. El azufre fundido es un líquido de color ámbar poco viscoso (su baja viscosidad se debe a la movilidad de los anillos de S8). Conforme aumenta la temperatura estos anillos comienzan a romperse para formar cadenas diradicalarias, S8, que a su vez pueden combinarse para dar cadenas de mayor tamaño. El aumento progresivo del tamaño de las cadenas confiere al azufre líquido una mayor viscosidad. Por encima de 190 ºC la viscosidad es máxima. Se estima que estas cadenas tienen un tamaño máximo y contienen 105 átomos de S. A partir de esa temperatura la viscosidad vuelve a disminuir progresivamente. Cuando se alcanzan los 444 ºC (temperatura de ebullición) el azufre se vuelve negro. El líquido presenta de nuevo una escasa viscosidad. Las cadenas se han dividido en otras mucho más cortas, (S8, S6, S4, S2) e incluso se han formado átomos libres, que pueden moverse con mayor facilidad. Por encima de 700 ºC predominan las especies S2 y S3 (análogas al O2 y O3).
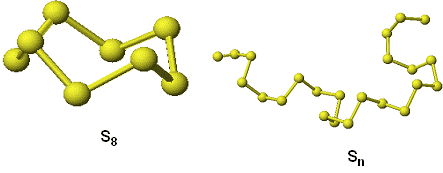
Finalmente, si se provoca un enfriamiento súbito sumergiéndolo en agua se obtiene un plástico de color marrón rojizo, de aspecto parecido al caucho. El enfriamiento rápido provoca la formación de cadenas muy largas helicoidales. Si se deja el tiempo suficiente, el plástico se vuelve frágil y llega a convertirse en la forma estable rómbica.
El siguiente esquema resume los cambios alotrópicos con la temperatura:
Efecto de la diferencia de electronegatividad entre le oxígeno y el azufre
Número de oxidación |
Ejemplos |
|---|---|
| -2 | Na2S, H2S |
| -1 | Na2S2, H2S2 |
| 0 | S8 |
| +1 | S2Cl2 |
| +2 | S2O3 |
| +2.5 | S4O6 |
| +3 | SO2, SF4 |
| +4 | H2SO3, SO32- |
| +5 | SO3, SF6 |
| +6 | H2SO4, SO42- |
Debido a que el azufre es menos electronegativo que el oxígeno puede formar compuestos en los que se encuentra en estado de oxidación positivo. El azufre puede tener estados de oxidación desde –2 a +6, incluyendo varios estados de oxidación “mixtos”, como +2.5 en el ion tetrationato, S4O62-.
Diagramas de Latimer y de Frost del azufre en medio ácido y en medio básico:
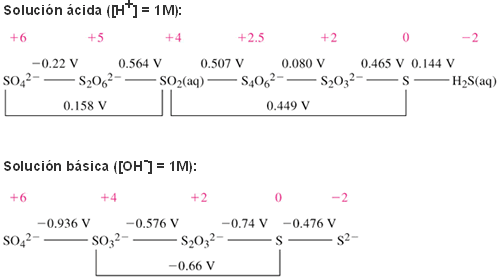
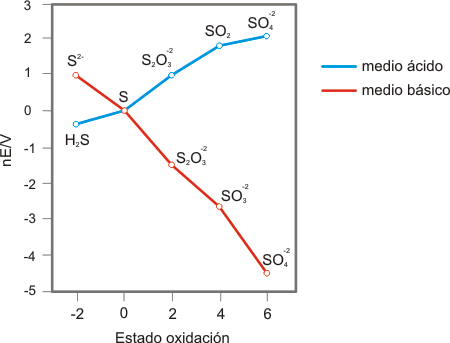
S(VI): La relativamente baja energía libre del ión sulfato en medio ácido indica que este ión sólo es débilmente oxidante en este medio mientras que, en medio básico, como es habitual para los oxoácidos, es mucho menos oxidante. Comparado con los demás elementos del grupo, el estado de oxidación (VI) el S es el más estable termodinámicamente.
S(IV): A pesar de que ambas curvas son ligeramente cóncavas, el estado de oxidación (IV) es bastante estable. En general en disoluciones ácidas el estado (IV) tiende a reducirse mientras que en disoluciones básicas tiende a oxidarse.
S(II): El tiosulfato (S2O3-2) es inestable en disoluciones ácidas respecto de su desproporción en S y SO32- En medio básico sin embargo es estable.
S(0): El elemento S tiende a reducirse en medio ácido pero a oxidarse en medio básico.
S(-II): el sulfuro es un agente reductor en medio básico mientras que su forma ácida (H2S) es una especie termodinámicamente estable. En cualquier caso, el estado de oxidación (-II) no es tan estable como en el caso del oxígeno. De hecho puede oxidarse a cualquiera de los estados de oxidación superiores.
A pesar de que se encuentra en estado nativo, el S es un elemento moderadamente reactivo. Todas las reacciones requieren que el ataque inicial abra el anillo S8 lo cual supone un cierto coste energético. Al ser calentado (T~250-260 ºC), el S elemental reacciona con oxígeno para producir SO2.
S (s) + O2 (g) → SO2 (g)
Se combina directamente con todos los halógenos y con numerosos metales y no metales. Reacciona prácticamente con todos los metales (excepto los más nobles Au, Pt, Ir) para dar los sulfuros (en ausencia de O2). Cuando estos sulfuros se encuentran en ambientes ricos en oxigeno, tienden a reaccionar formándose compuestos con presencia de enlaces S-O. Por ejemplo, el sulfuro de hierro (II) reacciona con el oxígeno para producir óxido de hierro (III) más dióxido de azufre
4 FeS (s) + 7 O2 → 2 Fe2O3 (s) + 4 SO2 (g)
La pirita, disulfuro de hierro, FeS2, dejada en un ambiente húmedo forma con el tiempo el sulfato de Fe (II).
4 FeS2(s) + 2 H2O (l) + 7 O2 → 2 FeSO4 (s) + 4 H2SO4 (g)
Algunas de las principales reacciones del S y del SO2 se resumen en el siguiente cuadro:
Efecto de la diferencia en la expansión de la capa de valencia en el azufre
El azufre presenta orbitales 3d de baja energía en su capa de valencia, de forma que expandir su octeto y albergar más de ocho electrones en ella. Así, por ejemplo, el oxígeno reacciona con flúor para formar el compuesto OF2(g):
O2(g) + 2 F2(g) → 2OF2(g)
La reacción se detiene en la formación de dicho compuesto porque el oxígeno no puede tener más de 8 electrones en su capa de valencia:
![]()
Debido a que el azufre puede expandir su capa de valencia, la reacción con flúor permite aislar los compuestos SF4 (10 electrones en la capa de valencia del S) y SF6 (12 electrones):
S8(s) + 16F2(g) → 8SF4(g)
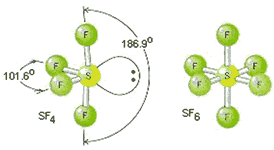
S8(s) + 24F2(g) → 8SF6(g)