Métodos aproximados
La ecuación de ondas de Schrödinger sólo presenta solución exacta para el átomo de hidrógeno o átomos de tipo hidrogenoide, es decir, que tienen un sólo electrón, como son He+, Li2+, Be3+, etc. El átomo más simple después del hidrógeno es el helio, el cual debe ser ya considerado un átomo polielectrónico. Al plantear la ecuación de ondas para este sistema, el término del potencial debe incluir ahora no sólo la interacción núcleo-electrones sino también la interacción electrón-electrón. Por ello, el valor del término que representa la energía potencial en el Hamiltoniano viene dado por:
V = -(∑ z* e2 / ri) + ∑ e2/rij
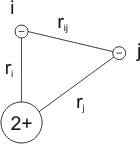
El átomo de helio.
Donde z* es la carga nuclear efectiva, que se describirá más adelante. Esta modificación del término del potencial hace inviable la solución exacta de la ecuación de ondas.
La solución exacta de la ecuación de ondas para un átomo de N electrones será función de las 3N coordenadas de cada uno de los electrones. No existen soluciones exactas para estas funciones tan complejas; sin embargo, es posible obtener soluciones aproximadas mediante cálculos numéricos de las energías y la densidad de probabilidad. Por ello hay que acudir a métodos aproximados para obtener dicha información. Uno de los más utilizados es el método de Hartree-Fock, o del campo autoconsistente. Este método parte de la asignación arbitraria de una función de onda razonable para cada uno de los electrones del átomo excepto para uno. Entonces se evalúa el efecto que tanto el núcleo como el resto de los electrones tienen sobre el electrón elegido, para así calcular la función de onda para éste, mediante la ecuación de Schrödinger. Una vez obtenida esta función, se repite el proceso con un electrón distinto, pero utilizando ya la función de onda mejorada para el electrón anterior. El proceso se repite hasta que se obtiene una función de onda mejorada para cada electrón. Entonces se comienza de nuevo el proceso y se repite una y otra vez hasta que las funciones de onda que se obtengan no difieran de las que proceden. Se dice entonces que dichas funciones de onda son autoconsistentes y que, por ello, constituyen una buena descripción del átomo.
Ψ = φ1φ2...φn → Ψ = φ1'φ2...φn→ Y = φ1'φ2'...φn ® Ψ = φ1'φ2'...φn' →
→ Ψ = φ1''φ2'...φn' → Ψ = φ1''φ2''...φn' → Ψ = φ1''φ2''...φn'' → ........ →
→ Ψ = φ1i'φ2i'...φni' → Ψ = φ1i'φ2i'...φni' → Ψ = φ1i'φ2i'...φni'
Estos cálculos demuestran que los orbitales de los átomos no son muy distintos de los orbitales encontrados para el átomo de hidrógeno. Las principales diferencias radican en la existencia de una carga nuclear efectiva que infiere un cierta contracción de los orbitales de los átomos polielectrónicos en comparación con sus homólogos del hidrógeno. Sin embargo, la similitud ha dado origen a la denominada aproximación del orbital, mediante la cual los electrones de los átomos polielectrónicos se ubican en orbitales atómicos basados en los conocidos para el átomo de hidrógeno.
La aproximación del orbital
Esta aproximación se describe matemáticamente asignando a cada electrón una función de onda (hidrogenoide), de forma que para un átomo con N electrones la función de onda del átomo es un producto de N funciones de onda:
Ψ = φ1φ2...φN
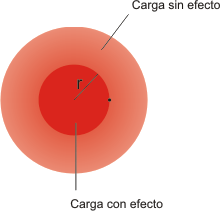
La carga nuclear efectiva
La repulsión interelectrónica se evalúa de forma aproximada suponiendo que la carga electrónica se distribuye en forma esférica alrededor del núcleo. Cada electrón se mueve bajo la atracción del núcleo y las repulsiones medias creadas por los restantes electrones. De acuerdo con la electrostática clásica, el campo creado por una distribución esférica de carga es el mismo que el que genera una carga puntual situada en el centro de la distribución (el núcleo). La magnitud de la carga puntual igual a la carga total dentro de una esfera de radio igual a la distancia entre el punto de interés y el núcleo. Ello se traduce en que el electrón experimenta una carga nuclear efectiva, Zef, que está determinada por la carga electrónica total de una esfera de radio igual a la distancia entre el electrón y el núcleo. Los electrones que se encuentran fuera de esta esfera no tienen un efecto neto sobre la carga nuclear efectiva. El valor de la carga nuclear efectiva depende de los valores de los números cuánticos n y l del electrón de interés, debido a que los electrones poseen distintas funciones de distribución radial en las diferentes capas y subcapas. La reducción de la carga nuclear real, Z, a la carga nuclear efectiva, Zef, se denomina apantallamiento. La carga nuclear efectiva puede expresarse como:
Zef = Z-σ, donde σ es la constante empírica del apantallamiento.
Cuanto más próximo esté el electrón al núcleo más aproximado será el valor de la carga nuclear efectiva al valor de la carga nuclear real, Z, porque el electrón sufre una menor repulsión de los otros electrones que constituyen el átomo. La carga efectiva tiene una extraordinaria importancia pues es la que se usa en los cálculos de las funciones de onda, sustituyendo a la carga nuclear Z. Slater propuso una serie de reglas, denominadas Reglas de Slater, para obtener un valor aproximado de Zef, y a las que se hará mención más adelante. De cualquier forma, estos valores han sido sustituidos por otros obtenidos a través de cálculos computacionales, y que mejoran sustancialmente aquellos.
El Principio de Pauli: el espín del electrón.
De acuerdo con la aproximación orbital, los dos electrones que forman parte del átomo de He, en su estado fundamental, ocuparían un orbital atómico que tiene la misma forma esférica que el orbital 1s del hidrógeno, pero que sería mucho más compacto pues la carga nuclear en el átomo de He es mayor que en el hidrógeno, y en consecuencia, los electrones son atraídos más fuertemente por el núcleo. La configuración electrónica del estado fundamental es la que deriva de la ocupación de los orbitales por los electrones del átomo en su estado de menor energía. Para el átomo de He, la configuración electrónica del estado fundamental es 1s2.
Al pasar al siguiente elemento, el Li, se plantean nuevos problemas. Su configuración electrónica del estado fundamental no es 1s3, ya que esta configuración está prohibida por el denominado Principio de Exclusión de Pauli, que enuncia que "el número máximo de electrones por orbitales es de dos y si existen 2 electrones ocupando un mismo orbital entonces sus espines deben de estar apareados". Todo electrón lleva asociado un momento magnético que está cuantizado en dos posibles orientaciones: de forma paralela o de forma opuesta a un campo magnético externo. La magnitud del momento magnético externo viene dada por:
μ = 2 √s (s+1) (en magnetones Bohr )
1 MB = [(eh)/(4πm)]10
donde s = |ms|, siendo ms el número cuántico de espín, que únicamente puede tomar los valores de ± 1/2. Para un átomo con dos electrones los espines pueden estar paralelos o antiparalelos. En el primer caso S = 1/2 + 1/2 = 1 y en el segundo caso S = 1/2 - 1/2 = 0:
↑↑ |
↑↓ |
paralelos,
S=1 |
apareados, S = 0 |
Aquellos átomos que tienen todos sus electrones apareados se denominan diamagnéticos, mientras que los que presentan electrones desapareados son paramagnéticos. En el caso de dos electrones con los espines paralelos, se produce una fuerte repulsión entre ellos, por lo que tienden a ubicarse en regiones distintas. Ello explica, de forma cualitativa, el Principio de Exclusión de Pauli. Si dos electrones tienen espines paralelos, están en orbitales distintos. Para que ocupen el mismo orbital, deben estar apareados (espines opuestos). Otra forma de enunciar este Principio es "en un mismo átomo no pueden existir 2 electrones con sus cuatro números cuánticos iguales".
En el caso del He los dos electrones que ocupan el orbital 1s deben de estar apareados. En el Li, el tercer electrón no puede ocupar el orbital 1s y por lo tanto pasará a ocupar un orbital de la siguiente capa (n = 2). Pero ¿qué orbital ocupará? ¿El orbital 2s o el orbital 2p? En el caso del hidrógeno todos los orbitales con igual valor de n tienen la misma energía. Pero los datos espectroscópicos y los cálculos teóricos demuestran que ello no es cierto para los átomos polielectrónicos. El siguiente epígrafe explica como distinguir, de forma cualitativa, entre estas dos posibles opciones.