Polaridad molecular
Es posible predecir la polaridad de un enlace covalente a partir de la diferencia de electronegatividad de los átomos unidos por el enlace. No obstante, una molécula que tiene enlaces polares puede ser polar o apolar. Dependiendo de la forma tridimensional de la molécula (geometría), las contribuciones de dos o más enlaces polares podrían cancelarse mutuamente, y en este caso se trataría de una molécula no polar. En una molécula polar hay una acumulación de densidad electrónica hacia un extremo de la molécula, lo que confiere a ese extremo una carga parcial negativa, δ-, y deja el otro extremo con una carga parcial positiva de igual valor, δ+ (figura 1).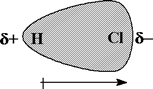
Figura 1. Una molécula polar.
Antes de examinar los factores que determinan si una molécula es polar o no, veamos cómo se puede medir experimentalmente la polaridad de una molécula. La moléculas polares experimentan una fuerza en un campo eléctrico que tienden a alinearlas con el campo (figura 2). Cuando el campo eléctrico se produce entre dos placas de carga opuesta, el extremo positivo de cada molécula es atraído hacia la placa negativa y el extremo negativo es atraído hacia la placa positiva. El grado en que las moléculas se alinean con el campo depende de su momento dipolar, μ, que se define como el producto de la magnitud de las cargas parciales (δ- y δ+) por la distancia de separación entre ellas.
μ = δd
La unidad derivada del momento dipolar es el coulomb-metro; una unidad derivada más cómoda es el debye (D), definido como 1 D = 3.34 x 10-30 C m. En la tabla 1 se dan algunos valores experimentales representativos.
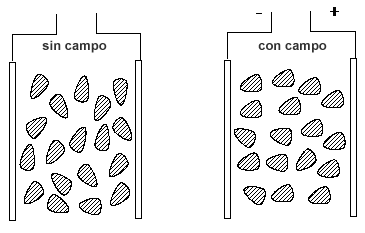
Figura 2. Moléculas polares en un
campo eléctrico.
Las moléculas no polares tienen un momento dipolar de cero; los momentos dipolares de las moléculas polares siempre son mayores que cero y aumentan al aumentar la polaridad de la molécula.
TABLA 1. Momentos dipolares de algunas moléculas.
| Molécula | Geometría | Momento dipolar (D) |
|---|---|---|
| H2 | Lineal | 0 |
| HF | Lineal | 1.78 |
| HCl | Lineal | 1.07 |
| HBr | Lineal | 0.79 |
| HI | Lineal | 0.38 |
| H2O | Angular | 1.85 |
| H2S | Angular | 0.95 |
| CO2 | Lineal | 0 |
| NH3 | Piramidal | 1.47 |
| NF3 | Piramidal | 0.23 |
| CH4 | Tetraédrica | 0 |
| CH3Cl | Tetraéd distors. | 1.92 |
| CH2Cl2 | Tetraéd distors. | 1.60 |
| CHCl3 | Tetraéd distors. | 1.04 |
| CCl4 | Tetraédrica | 0 |
Para predecir si una molécula es polar o no, necesitamos considerar si la molécula tiene o no enlaces polares y las posiciones relativas de estos enlaces. Podemos correlacionar los tipos de geometría molecular con el momento dipolar aplicando una regla general a una molécula de tipo ABn (A es el átomo central, B es el átomo terminal y n es el número de átomos terminales). Una molécula de este tipo no será polar si satisface todas las condiciones siguientes:
Moléculas no polares.
- Todos los átomos (o grupos) terminales son iguales, y
- Todos los átomos (o grupos) terminales están dispuestos simétricamente alrededor del átomo central, A, en la disposición geométrica que se da en la figura 3, y los átomos (o grupos) terminales tienen las mismas cargas parciales.
Esto quiere decir que aquellas moléculas cuya geometría molecular es la de la figura 3 no pueden ser polares si sus átomos (o grupos) terminales son iguales.
Por otra parte una molécula es polar si cumple con cualquiera de las condiciones siguientes:
Moléculas polares
- Uno o más átomos terminales diferentes de los otros, o
- Los átomos terminales no están dispuestos simétricamente.
Consideremos, por ejemplo, los momentos dipolares de CF4 (μ = 0 D) y CF3H (μ = 1.60 D). Ambos tienen la misma forma molecular con sus átomos dispuestos tetraédricamente alrededor de un átomo de carbono central. Todos los átomos de flúor terminales son iguales en el CF4, así que tienen las mismas cargas parciales. En cambio, los átomos terminales del CF3H no son todos iguales; el F es más electronegativo que el H, lo que hace que el dipolo del enlace C–F tenga una carga negativa parcial más grande que el de C–H. Por consiguiente, el CF4 es una molécula no polar y el CF3H es polar.
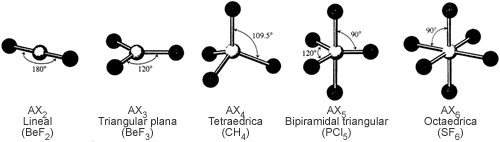
Figura 3. Geometría predichas por el modelo VSEPR para moléculas de los tipos AX2 a AX6 que contienen únicamente enlaces covalentes sencillos.
![]()
Como ejemplo adicional, consideremos al dióxido de carbono, CO2, una molécula triatómica lineal. Cada enlace C=O es polar porque el oxígeno es más electronegativo que el carbono, así que O es el extremo parcialmente negativo del dipolo del enlace. Todos los átomos de oxígeno están a la misma distancia del átomo de carbono, ambos tienen la misma carga d-, y están dispuestos simétricamente a cada lado del C. Por tanto, sus dipolos de enlace se cancelan y producen un momento dipolar molecular de cero. Aunque cada enlace C=O es polar, el CO2 es una molécula no polar.
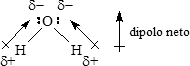
La situación es diferente en el agua, una molécula triatómica angular. Aquí, ambos enlaces O–H son polares, y los átomos de H tienen la misma carga d+. Observe, empero, que los dipolos de enlace no están dispuestos simétricamente; no apuntan directamente el uno al otro o en la dirección opuesta, sino que se suman para dar un momento dipolar de 1.85 D (Tabla 1). Así el agua es una molécula polar.