Introducción
El hidrógeno es el elemento más abundante del universo y también de nuestro planeta, siendo el tercer elemento en abundancia en la corteza terrestre (por detrás del oxígeno y el silicio). El hidrógeno, formando compuestos, representa el 15.4% de los átomos de la corteza terrestre y los océanos, siendo el noveno elemento en cuanto abundancia en peso.
En 1671, R. Boyle observó que el ataque del ácido sulfúrico diluido al hierro metálico generaba un gas inflamable, sin caracterizarlo aún:
H2SO4 (ac) + Fe(s) → FeSO4 (ac) + H2(g)
En 1766 H. Cavendish estableció las propiedades del hidrógeno, llevando a cabo las reacciones de diversos ácidos diluidos con hierro, zinc y estaño, y mostrando que este gas era más ligero que el aire. En 1781, Cavendish observó que se formaba agua de las explosiones obtenidas por reacción entre el hidrógeno y el oxígeno, descubriendo, por lo tanto, que el agua no era un elemento en sí. En 1783, A. L. Lavoisier le dio el nombre de hidrógeno (del griego, origen del agua).
Propiedades Físicas del Hidrógeno
La configuración electrónica del hidrógeno es la más simple de las que existen (1s1), pero a pesar de su simplicidad, el hidrógeno puede existir de más de 40 formas distintas, la mayoría de las cuales han sido bien caracterizadas. Esta diversidad de formas se debe, en primer lugar, a la existencia de especies atómicas, moleculares e iónicas en fase gaseosa: H, H2, H+, H¯, H2+ y H3+; en segundo lugar, a la existencia de tres isótopos, 11H, 21H (D, deuterio), 31H (T, tritio) y sus especies correspondientes D, D2, HD, DT, etc.; y por último, a la existencia de isómeros de espín nuclear en las especies diatómicas homonucleares, como el orto y el para-hidrógeno, como se estudiará más adelante.
Isótopos del Hidrógeno
Los compuestos de la naturaleza que contienen al hidrógeno, poseen átomos en los que el núcleo predominantemente es el protón. Así, el hidrógeno terrestre contiene 0.0156% de deuterio, mientras que el tritio se presenta en la naturaleza sólo en cantidades mínimas, del orden de 1 en 1017.
El tritio (con un núcleo formado por dos neutrones y un protón) se forma en las capas altas de la atmósfera debido a reacciones nucleares. El tritio posee un espín nuclear de 1/2 y una masa atómica de 3.016. Es radioactivo con una vida media de 12.4 años. Se puede producir artificialmente en los reactores nucleares.
El deuterio contiene un protón y un neutrón y posee un espín nuclear de 1. Su masa atómica es de 2.0141 umas y es estable. Se separa del agua como D2O, por destilación fraccionada o por electrólisis.
El hidrógeno contiene tan sólo un protón en su núcleo, y su espín nuclear es de 1/2. Su masa atómica es de 1.0078 y es estable. El hidrógeno molecular, H2, es un gas incoloro e inodoro, insoluble en agua, que posee bajos puntos de fusión y ebullición. Las diferencias de las masas atómicas entre los tres isótopos ocasionan diferencias en las propiedades físicas de los isótopos en su forma molecular como se observa en la Tabla 1:
Tabla 1. Algunas propiedades físicas de los isótopos del hidrógeno.
Propiedades |
H2 |
D2 |
T2 |
|---|---|---|---|
| Punto de fusión (K) | 13.957 | 18.73 | 20.62 |
| Punto de ebullición (K) | 20.39 | 23.67 | 25.04 |
| ΔHºdis (kJ/mol) | 435.9 | 443.4 | 469.9 |
| dA-A (Å) | 0.7414 | 0.7414 | 0.7414 |
| Energía en el punto cero (kJ/mol) | 25.9 | 18.5 | 15.1 |
Como puede observarse, los puntos de fusión y de ebullición del D2 y del T2 son más altos que los del H2. Por otro lado, los altos valores de las entalpías de disociación ponen de manifiesto la existencia de un fuerte enlace H-H, siendo éste el enlace simple más fuerte que se conoce. Este hecho es el responsable de la inercia química del H2 a la temperatura ambiente. Se produce una descomposición térmica apreciable de H2 a H atómico a 2000 K, con un porcentaje de hidrógeno atómico del 0.081%. Esta cantidad aumenta al 7.85% a 3000 K y al 95.5% a temperaturas del orden de 5000 K.
Formas ionizadas del hidrógeno
Este apartado trata de manera resumida las siguientes formas ionizadas: el protón, H+, el ion hidruro, H-, la molécula de hidrógeno ionizada, H2+, y la especie triatómica de 2-electrones H3+.
La energía de ionización del átomo de hidrógeno (1311 kJ/mol) es muy elevada y más próxima a las de los halógenos que a las de los metales alcalinos. Si se ioniza un átomo de hidrógeno, es decir, si se le arranca el electrón 1s1 se genera un protón desnudo, de radio 1.5x10-3 pm. Esta especie no es estable en fase líquida, pero sí se conocen especies químicas que contienen asociadas un protón como el H3O+, el NH4+, etc. La afinidad protónica del agua y la entalpía de disolución del H+ en agua se estiman en los siguientes valores:
H+ (g) + H2O (g) → H3O+ (g). -ΔH = 720 kJ/mol
H+ (g) → H3O+ (ac) ΔH = 1090 kJ/mol
El átomo de hidrógeno presenta afinidad por los electrones, siendo la afinidad electrónica la energía asociada con el siguiente proceso:
H (g) + e → H¯ (g) AE = -ΔH = 72 kJ/mol
Este valor se encuentra entre la AE del Li (2s1) y el flúor (2s2p5): AE(Li) = 57 kJ/mol, y AE(F) = 333 kJ/mol. El ion H¯ tiene la misma configuración electrónica que el He, pero es mucho menos estable debido a que un único protón debe controlar 2 electrones. Como consecuencia de ello, el ion H¯ es muy deformable.
Las especies H2+ y H3+ no son de interés por su química, más bien escasa, sino porque sirven de sistemas modelo en las teorías de enlace. La molécula de H2+, que posee dos protones y un electrón, es extremadamente inestable. Existe cierta incertidumbre sobre la entalpía de disociación y la distancia internuclear, pero recientes estudios han estimado su valor en: ΔHdis = 255 kJ/mol y r(H-H) = 106 pm (por ΔHdis = 436 kJ/mol y r(H-H) = 74.2 pm del H2).
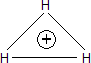
Thompson detectó por primera vez la molécula ionizada H3+ en un tubo de descarga. Su masa de 3.027 uma la diferencia del tritio (3.016). La estructura triangular de 3-centros-2-electrones de esta especie es más estable que la hipotética estructura lineal:
Orto y para-hidrógeno
Los dos átomos de hidrógeno en una molécula poseen cada uno lo que se denomina espín nuclear I (similar al electrónico). El valor de mI (momento de I) para el hidrógeno puede ser +1/2 o -1/2. Así pues, los dos espines pueden estar paralelos o antiparalelos. En el primer caso el hidrógeno se denomina orto mientras que en el segundo se denomina para. La multiplicidad de espín viene dada por 2S+1, siendo S = ∑mI , por lo que en el orto-hidrógeno S = 1 y la multiplicidad es 3. Se dice entonces que es un estado triplemente degenerado. En el para-hidrogeno S = 0 y la multiplicidad vale uno, luego no existe degeneración en este estado. El para-hidrógeno posee menor energía y es el estado más favorable a bajas temperaturas. Por encima del 0 K, se comienza a incrementar gradualmente la concentración de orto-hidrógeno, hasta que, por encima de la temperatura ambiente, la proporción llega a ser de 3 de orto por 1 de para.
La mayoría de las propiedades físicas apenas se afectan por la isomería del espín nuclear, aunque la conductividad térmica del p-H2 es el 50% mayor que la del o-H2.