El hidrógeno se combina con la mayoría de los elementos del sistema periódico para formar hidruros binarios de fórmula, MHx o MmHn. Estos compuestos del hidrógeno se dividen en tres clases principales:
Hidruros salinos
Son combinaciones del hidrógeno con los elementos más electropositivos (elementos alcalinos y alcalinotérreos, con excepción del Be, cuyo enlace con el hidrógeno es covalente). Son compuestos iónicos, no volátiles, no conductores en estado sólido y cristalinos. En estos compuestos el hidrógeno se encuentra como ion hidruro H¯.
Hidruros moleculares o covalentes
Son combinaciones del hidrógeno con los elementos no metálicos de los grupos p. Son sustancias volátiles y presentan enlace convalente.
Hidruros metálicos
Son combinaciones del hidrógeno con los elementos metálicos de las series d y f. Generalmente son compuestos no estequiométricos y presentan propiedades metálicas como la conductividad.
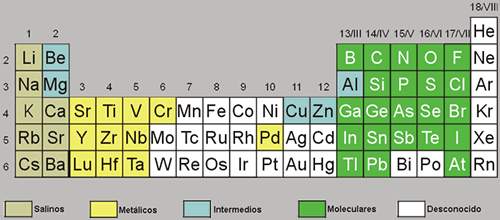
Figura 2. Los hidruros conocidos.
Los Hidruros Salinos
Los hidruros salinos se caracterizan formalmente por contener al hidrógeno en estado de oxidación –1, y existen sólo para los metales más electropositivos (Grupos 1 y 2). Los hidruros de los elementos alcalinos presentan estructura de tipo NaCl, mientras que las de los hidruros de los elementos alcalinotérreos son similares a las de los haluros de metales pesados como el PbCl2 (excepto el MgH2 que presentan estructura tipo rutilo, TiO2). De ahí la denominación de hidruros salinos. El radio iónico del H¯varía entre 1.26 Å en el LiH y 1.54 Å en el CsH. Esta variación se explica en función de la dificultad para el único protón nuclear para atraer a los dos electrones, lo que hace que esta especie sea fácilmente deformable o compresible (es un especie blanda).
Los hidruros salinos son insolubles en disoluciones no acuosas, con excepción de los haluros alcalinos fundidos, donde son muy solubles. La electrólisis de los hidruros fundidos originan H2 en el ánodo, lo que es consistente con la presencia de iones H¯. Otros hidruros tienden a descomponerse antes de fundirse.
2H¯ (en sal fundida) → H2(g) + 2e
Los hidruros salinos, generalmente sólidos blancos o grises, se obtienen generalmente mediante reacción directa del metal con hidrógeno a altas temperaturas. Los hidruros se utilizan como desecantes y reductores, como bases fuertes y algunos como fuentes de H2 puro. El CaH2 es particularmente útil como agente desecante de disolventes orgánicos, reaccionado suavemente con el agua. El CaH2 también se puede emplear para reducir los óxidos metálicos a metal:
CaH2 (s) + 2H2O (l) → Ca2+(ac) + 2H2(g) + 2OH¯(ac)
CaH2 (s) + MO(s) → CaO(s) + M(s) + H2(g)
El hidruro sódico reacciona violentamente con el agua, pudiendo llegar a inflamarse con la humedad del aire:
NaH(s) + H2O (l) → Na+(ac) + H2(g) + OH-(ac)
Cuando se produce un incendio por la inflamación de NaH, nunca se debe apagar con agua, ni tampoco, con CO2, ya que éste produce más llamas. Estos incendios se apagan con extintores de polvo como los de SiO2 (sílice).
Uno de las aplicaciones de los hidruros salinos, como el NaH, es la formación de otros hidruros:
NaH (s) + B(C2H5)3 (éter) → Na[HB(C2H5)3] (éter)
El LiH reacciona con el cloruro de aluminio para formar un hidruro complejo de litio y aluminio, LiAlH4, que es muy útil como agente reductor en Química Orgánica.
Al2Cl6 (éter)+ 8 LiH (éter) → 2LiAlH4 (éter) + 6LiCl(s)
Hidruros Metálicos
El hidrógeno reacciona con diversos metales de transición, incluyendo los lantánidos y actínidos, para producir un tipo de hidruros cuya naturaleza aún no se conoce en su totalidad. La Figura 3 muestra los hidruros conocidos de este tipo:
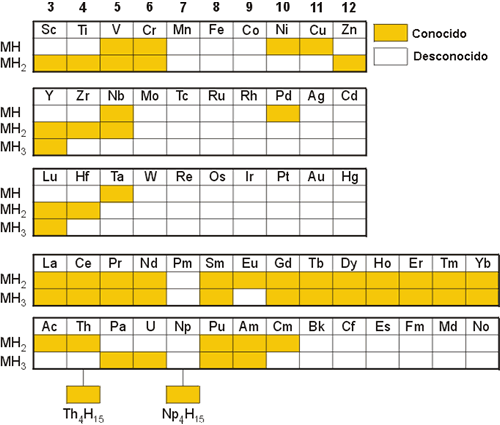
Figura 3. Hidruros metálicos conocidos.
Los hidruros de los grupos 7-12 o no existen o son poco conocidos, con excepción de los hidruros de Pd, Ni, Cu y Zn. Generalmente, son sólidos quebradizos, presentan apariencia metálica, y son buenos conductores de la electricidad y son de composición variable. La conductividad varía con la mayor o menor ocupación de la banda de conducción o del dopado de hidrógeno. De esta manera, el CeH3-x es conductor y sin embargo el CeH3 es aislante, ya que presenta la banda de conducción llena.
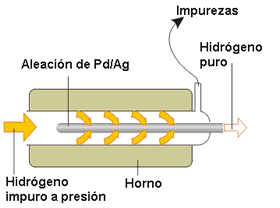
Figura 4. Purificación de hidrógeno.
Una de las características típicas de los hidruros metálicos es la gran velocidad de difusión del hidrógeno a través del sólido a elevadas temperaturas. Esta cualidad se emplea para obtener H2 de alta pureza mediante difusión a través de un tubo de aleación de Pd-Ag (Figura 4).
Estos hidruros se forman fácilmente por combinación directa del hidrógeno gas y el metal. Este proceso se invierte a altas temperaturas, pudiendo liberar hidrógeno gas y el metal finamente dividido. Por tanto estos compuesto suponen una buena forma de almacenar hidrógeno. Por ejemplo, el compuesto LaNi5 forma una fase con el hidrógeno de composición LaNi5H6. Este compuesto contiene más hidrógeno por unidad de volumen que el propio H2 líquido y se emplea para el almacenamiento de H2. Un sistema alternativo y más económico es el de composición FeTiHx (x<1.95), que es un sistema comercial que se emplea en determinado prototipo de vehículos.
Hidruros Moleculares
Se pueden dividir en tres categorías:
i) Compuestos deficientes en electrones: aquellos que poseen un número menor de electrones que de enlaces. Un ejemplo de este tipo de hidruros es el diborano:
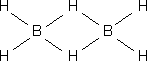
B: 1s22s2p1.............3x2 = 6
H:
1s1.....................1x6 = 6
12e
Hay 12 electrones y 8 enlaces: Los enlaces en el puente so de 3 centros y dos electrones:
Cada boro aporta un electrón a uno de los
enlaces en los puentes + 1 electrón del H =2e
ii) Compuestos ricos en electrones: aquellos donde hay más pares de electrones que enlaces. Un ejemplo de este tipo es el amoniaco:
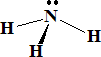
H3.........................N: 1s22s2p3....................5e
H: 1s1.........................3x1e
8e
Hay 4 pares de electrones y sólo tres enlaces. El nitrógeno posee un par de electrones sin compartir.
iii) Entre los compuestos deficientes y los ricos en electrones se encuentran aquellos donde el número de pares de electrones es el mismo que el de enlaces. Por ejemplo el CH4:
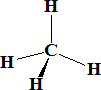
CH4.........................C: 1s22s2p3....................4e
H: 1s1.........................4x1e
8e
4 pares de electrones y 4 enlaces.
Las estructura de este tipo de hidruros puede predecirse mediante las reglas de VSEPR. Así, el CH4 es tetraédrico, el NH3 es piramidal y el agua es lineal.
También es posible encontrar hidruros en los complejos de los metales de transición, en los que el H forma parte de la molécula compleja como ligando: [FeH2(CO)4], [Co(CO)4H] y [ReH9]-2..