Introducción
Los elementos halógenos son aquellos que ocupan el grupo 17 del Sistema Periódico. Los halógenos F, Cl, Br, I y At, son elementos volátiles, diatómicos y cuyo color se intensifica al aumentar el número atómico. El flúor es un gas de color amarillo pálido, ligeramente más pesado que aire, corrosivo y de olor penetrante e irritante. El cloro es un gas amarillo verdoso de olor penetrante e irritante. El bromo a la temperatura ambiente es un líquido de color rojo oscuro, tres veces más denso que el agua, que se volatiliza con facilidad produciendo un vapor rojizo venenoso. El yodo es un sólido cristalino a temperatura ambiente, de color negro y brillante, que sublima dando un vapor violeta muy denso, venenoso, con un olor picante como el del cloro. El Astato es un elemento muy inestable que existe sólo en formas radiactivas de vida corta, y que aparece en el proceso de desintegración del 235U. En la Tabla 1 se muestran algunas de las propiedades físicas y atómicas de los elementos de este grupo.
Todos los átomos poseen una configuración que difiere de la de gas noble en un electrón, de forma que los elementos tienden a formar especies negativas, X¯, o a formar enlaces covalentes simples. La química de estos elementos y sus compuestos cambian con el tamaño de los mismos.
Como es esperable, los puntos de fusión y ebullición aumentan al descender en el grupo. Las energías de ionización de los halógenos presentan valores muy altos que van disminuyendo al aumentar el número atómico. Las afinidades electrónicas son elevadas como consecuencia de la tendencia a ganar un electrón y conseguir así la configuración de gas noble.
Tabla 1. Propiedades físicas de los halógenos
| Elemento | Flúor |
Cloro |
Bromo |
Yodo |
|---|---|---|---|---|
| Configuración | [He]2s2p5 |
[Ne]3s2p5 |
[Ar]3d104s2p5 |
[Kr]4d105s2p5 |
| Masa Atómica (uma) | 18,9984 |
35,4527 |
79,904 |
126,90447 |
| Punto de Fusión (K) | 53,6 |
172,18 |
265,9 |
386,7 |
| Punto de Ebullición (K) | 85 |
239,2 |
331,94 |
457,5 |
| Densidad (kg/m³) | 1516 |
2030 |
4050 |
4930 |
| Calor de Fusión (kJ/mol) | 1,0 |
6,4 |
10,8 |
15,3 |
| Calor de Vaporización (kJ/mol) | 6,5 |
20,4 |
29,6 |
42,0 |
| Calor de Atomización (kJ/mol de átomos) | 79,0 |
121,0 |
112,0 |
107,0 |
| Estados de Oxidación | -1 |
-1, +1, +2,
+3 , +4, +5, +6, +7 |
-1, +1, +3
, +4, +5, +7 |
-1, +1, +3
, +5, +7 |
| 1ª Energía de Ionización (kJ/mol) | 1681 |
1251,1 |
1139,9 |
1008,4 |
| 2ª Energía de Ionización (kJ/mol) | 3374,1 |
2297,3 |
2103,4 |
1845,8 |
| 3ª Energía de Ionización (kJ/mol) | 6050,3 |
3821,8 |
3473,4 |
3184 |
| Afinidad Electrónica (kJ/mol) | 328 |
349 |
324,7 |
295,2 |
| Radio Atómico (Å) | 0,57 |
0,97 |
1,12 |
1,32 |
| Radio Covalente (Å) | 0,72 |
0,99 |
1,14 |
1,33 |
| Radio Iónico (Å) | F- = 1,31 |
Cl- = 1,81 Å Cl+7 = 0,26 Å |
Br- = 1,95 Br+7 = 0,39 |
I- = 2,16 I+7 = 0,50 |
| Volumen Atómico (cm³/mol) | 17,1 |
22,7 |
23,5 |
25,74 |
| Polarizabilidad (ų) | 0,6 |
2,2 |
3,1 |
5 |
| Electronegatividad (Pauling) | 3,98 |
3,16 |
2,96 |
2,66 |
Abundancia Natural
Debido a su reactividad, ninguno de los halógenos se encuentra en estado libre en la naturaleza. Generalmente, se encuentran en forma de haluros (X¯), siendo el fluoruro el más abundante en la corteza terrestre. Además de la gran cantidad de depósitos minerales de haluros, particularmente NaCl y KCl, existen una cantidad enorme de cloruro y bromuro en las aguas de los océanos. La Figura 1 muestra un diagrama con las cantidades relativas de estos elementos.
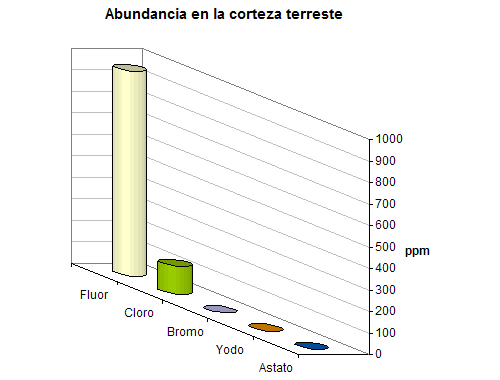
Figura 1. Abundancia de los haluros
Flúor
El flúor es más abundante en la corteza terrestre (0.065%) que el cloro (0.055%), ocupando el 17º lugar en orden de abundancia en la misma. El flúor se presenta en la naturaleza en forma combinada como fluorita (CaF2), criolita (Na3AlF6) y fluorapatita (Ca5(PO4)3F).
La fluorita, de la que se deriva generalmente la mayoría de los compuestos de flúor, se obtiene de minas en los Estados Unidos en grandes depósitos en el norte de Kentucky y el sur de Illinois. La criolita es un mineral escaso del cual existen pocos yacimientos (sólo en Groenlandia). Se emplea como material de partida en la industria del aluminio, pero por lo general la criolita que se emplea es de tipo sintético. La fluoroapatita es el mineral más abundante de flúor, pero su contenido en flúor es tan pequeño (3.5% en peso) que se utiliza sólo para obtener su contenido en fosfato.
El flúor también se presenta como fluoruros en el agua del mar, ríos, y en formas minerales, en los tallos de ciertos pastos y en los huesos y dientes de animales.
Cloro
Es el 20º elemento en orden de abundancia de la corteza terrestre. Además de los grandes depósitos naturales de sal común, NaCl, existen reservas ingentes de cloro en el océano, con un 3.4% en peso de sales, de las cuales, el 1.9% son sales de iones cloruros.
Bromo
El bromo es sustancialmente menos abundante que el cloro o el flúor en la corteza terrestre. Como el cloro, la mayor fuente natural del bromo está en los océanos (en concentraciones de 65 mg/ml). La relación de masas del Cl:Br en el agua del mar es de 300:1.
Yodo
El yodo es considerablemente menos abundante que los halógenos anteriores, tanto en la corteza terrestre como en la hidrosfera. Se encuentra en forma de yodatos, como los depósitos naturales de laurita (Ca(IO3)2) y dietzeita (7Ca(IO3)2x8CaCrO4). También se encuentra como yodo elemental en los yacimientos de nitrato de Chile. El contenido de yodo en agua es demasiado bajo como para poder explotar estos yoduros desde el punto de vista industrial.
Astato
El astato recibe su nombre del griego "inestable". De hecho, es un elemento radioactivo. El astato se origina en la serie radioactiva del 235U, pero de una manera colateral:
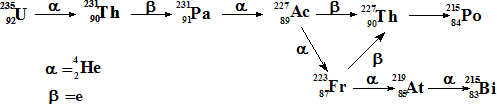
Se preparó por primera vez mediante la reacción en un ciclotrón, entre el 209Bi y partículas a:
![]()
No se conocen bien propiedades físicas del elemento debido a que los isótopos del At poseen vidas medias de sólo horas.