El único método importante para preparar F2 se debe a Moissan y se basa en la electrólisis de una mezcla fundida de HF y KF. Moissan originalmente empleó una relación molar KF:HF de 1 : 13, lo que obligaba a trabajar a temperaturas del orden de -24 ºC para evitar una alta presión de vapor de HF a esas concentraciones. Los sistemas electrolíticos que poseen relaciones molares de 1:2 ó 1:1 funden a temperaturas de 72 y 240 ºC, respectivamente, y tienen presiones de vapor más bajas. El HF se descompone por electrólisis en hidrógeno y flúor.
2HF → H2(g) + F2(g)
El KF proporciona la conductividad del medio necesario para la electrólisis.
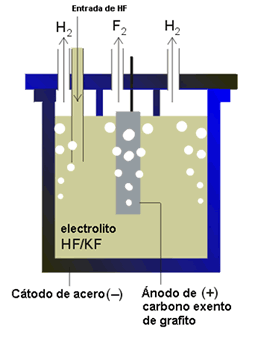
Figura 2. Celda de producción de flúor
Descripción de la celda: la celda utilizada (Figura 2) está constituida por un cátodo de acero y un ánodo de carbón, exento de grafito. La celda misma es de acero.
El cátodo y el ánodo no están separados por un diafragma, sino por una pantalla de metal monel (Cu/Ni) perforada por debajo de la superficie del líquido, pero no por encima de él, para evitar que el flúor y el hidrógeno se mezclen. Se trabaja a un voltaje de 8-12 V (Eº(F2/F-) = 2.85 V) y el rendimiento es del 90-95% (en base a la corriente consumida). Se prefieren las celdas que operan a temperaturas moderadas que las de alta temperatura, por las siguientes razones: i) menor presión de HF en la celda, ii) menores problemas de corrosión, y c) mayor tiempo de vida del ánodo.
Un problema en los antiguos generadores residía en la formación de compuestos de grafito y flúor que son altamente explosivos. Estos problemas se han subsanado en la actualidad, siendo posible producir F2 tanto al nivel industrial como a escala laboratorio sin que el proceso sea peligroso.
El diseño que se muestra en la Figura 2 representa una celda típica de obtención de F2. El electrolito KF-HF está en una proporción 1:2 y la temperatura de trabajo es de 80-100 ºC, que se mantiene constante, bien por calentamiento, en los momentos iniciales cuando la celda no está trabajando, o bien por enfriamiento cuando la celda está funcionando. Las celdas a escala laboratorio operan entre 10-50 Amperios, mientras que las de escala industrial consisten en bloques de celdas, que operan entre 4000-8000 amperios. Una celda industrial tipo mide 3x0.8x0.6 m3 y tiene capacidad para una tonelada de electrolito.
El F2 se comercializa en botellas de presión de 230 g a 2.7 Kg de capacidad. Se transporta en tanques refrigerados con N2 (su punto de ebullición es de 8 ºC por debajo del punto de ebullición de F2).
El 70-80 % del F2 elemental que se produce al nivel mundial se emplea en la fabricación de UF6, que se utiliza para producir energía nuclear. Para ello se necesita 235U, que es el isótopo radioactivo. Como el uranio presenta varios isótopos, es necesario enriquecer este compuesto en 235U. Para llevar a cabo esto se emplea el método de la difusión gaseosa. El uranio se transforma en UF6; debido a que el flúor sólo tiene un isótopo, por lo que el número de compuestos isotópicos de UF6 será igual a número de isótopos del uranio. El hexafluoruro de uranio es un compuesto sólido que sublima fácilmente, y en estado gaseoso puede difundirse a través de membranas porosas un gran número de veces, El compuesto más ligero pasa antes de manera que UF6 se puede enriquecer en 235U.
Otras aplicaciones importantes de F2 son la preparación de SF6 que se emplea como dieléctrico y la fabricación de agentes fluorantes más versátiles como el ClF3, BrF3 y IF5.