La Química de la Coordinación
En el contexto de la química de los elementos del bloque d o metales de transición, el término complejo se emplea para indicar a un compuesto en el que un átomo o ion metálico está rodeado por un conjunto de otros átomos, moléculas o iones denominados ligandos. Un ligando es una molécula o ion que presenta una existencia independiente (Cl-, H2O, NH3, CO,...). Un ejemplo de complejo es el ion [Co(NH3)3]3+, en el que el ion Co3+ está rodeado por seis ligandos NH3. El término compuesto de coordinación se emplea para designar a un complejo neutro o a un compuesto iónico en el que al menos uno de los iones es un complejo; ejemplos: [Ni(CO)4], [Co(NH3)6]Cl3.
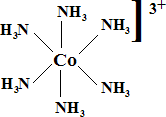
Un complejo es el resultado de la combinación de un ácido de Lewis (átomo metálico central) y un número determinado de bases de Lewis (ligandos). El átomo de la base de Lewis que cede formalmente su par de electrones al ácido se le denomina átomo donador. Por otra parte, el ácido de Lewis en el complejo es el átomo aceptor. Es decir, el enlace metal-ligando es un enlace de tipo dativo que implica la donación de un par de electrones del ligando al metal.
Tipos de ligandos
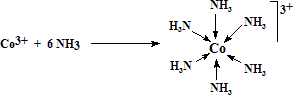
Una característica común de los ligandos en los complejos es la capacidad para ceder pares de electrones a los átomos o iones metálicos centrales. Los ligandos son bases de Lewis que se pueden clasificar atendiendo al número de átomos unidos al centro metálico en:
Ligandos monodentados:
Ocupan una única posición en la esfera de coordinación del metal (se unen al ion metálico por un sólo átomo). Pueden ser ligandos aniónicos (F-, Cl-, Br-, I-, CN-, SCN-...) o ligandos neutros (NH3, H2O, CO,...).
Ligandos polidentados
Ocupan más de una posición de coordinación. Por ejemplo, la etilendiamina, en, (NH2CH2CH2NH2), el bipiridilo, bipy, son ligandos bidentados (ocupan dos posiciones en la esfera de coordinación del metal), mientras que el AEDT (ácido etilendiaminotetracético) o las porfirinas, son ligando polidentados porque se unen al centro metálico a través de seis o cuatro átomos, respectivamente. Un ligando polidentado es también un agente quelatante porque cuando se une al ion metálico forma un anillo, normalmente de cinco o seis miembros, denominado quelato (fig 4)
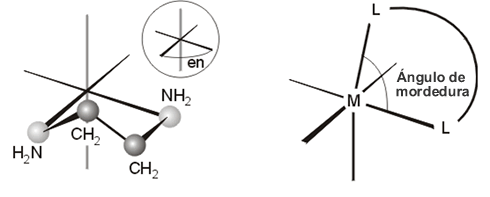
Figura 4. Ligando etilendiamina (izquierda) y ángulo de mordedura (derecha)
Un ligando puede ser ambidentado si posee diferentes átomos donadores. Un ejemplo de este tipo de ligandos es el ion tiocianato NCS-, que puede unirse al metal tanto por el átomo de N, para dar complejos de isotiocianato, como por el de S, para dar complejos de tiocianato. Otro ejemplo de ligando ambidentado es el ion NO2-; si se une al ion metálico de la forma M-NO2 se denomina ligando nitro y si se une por el átomo de oxígeno, M-ONO se denomina nitrito (Figura 5). Estos ligandos dan lugar a un tipo de isomería estructural denominada isomería de enlace (ver abajo)
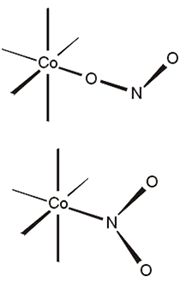
Figura 5. Ligandos nitrito y nitro.