El ozono, O3, es una alótropo termodinámicamente inestable del oxígeno (DGf = +163 kJmol-1).
Es un gas azulado a temperatura ordinaria. Sus puntos de fusión y ebullición son mayores que los de la molécula de dioxígeno, lo que indica que las fuerzas intermoleculares son de mayor magnitud. Es muy poco soluble en agua. Tiene un fuerte olor (se detecta en muy bajas concentraciones 0.01 ppm). Su nombre procede de la raíz griega ozein; podemos olerlo. Es una molécula con momento dipolar consecuencia de una geometría no lineal. Es termodinámicamente inestable y se descompone formando O2. Esta reacción transcurre lentamente por motivos cinéticos pero puede acelerarse por la presencia de sustancias que actúen como catalizadores o por la acción de radiación ultravioleta.
3O2 → 2O3 ΔGºf = 163 kJmol-1
Es una molécula diamagnética, extremadamente tóxica (máxima exposición 0.1 ppm). Se produce en zonas con un alto voltaje (fotocopiadoras, impresoras láser, etc) y es causante de dolores de cabeza en ambientes de oficina. Sin embargo su presencia en la troposfera nos protege de la radiación ultravioleta. El proceso de descomposición del ozono transcurre en dos etapas:
O3 (g) ![]() O2 (g) + O (g)
O2 (g) + O (g)
O3 (g) + O (g) ![]() 2O2 (g)
2O2 (g)
Es un agente oxidante muy potente (mucho más que el dioxígeno)
O3(g) + H2O (l) + 2e- → O2(g) + 2 OH- (ac) medio básico Eo = 2.07 V
O2(g) + 4 H+(aq) + 4e- → 2 H2O(l) medio ácido Eo = 1.23 V
Es, junto con el F2, el F2O y el oxígeno atómico, uno de los agentes oxidantes más potentes que se conocen. Es este poder oxidante el que permite su uso como bactericida de forma alternativa a la cloración. El inconveniente es que su acción es poco prolongada. Su ventaja: el producto de reacción, O2, es inocuo; evita el desagradable olor y sabor a cloro el agua. Además el cloro reacciona con hidrocarburos para producir productos clorados (CHCl3) que ha sido identificados como posibles cancerígenos.
Es un agente de transferencia de oxígeno:
CN- + O3 → OCN- + O2
3 I- + O3 + 2H+ → I3- + O2 + H2O
(reacción utilizada para la determinación analítica del ozono)
Reacciona con los hidrocarburos insaturados, atacando al doble enlace formando ozónidos que son especies intermedias inestables útiles en síntesis orgánica:
Forma compuestos con los alcalinos y alcalino-térreos. Estos compuestos contienen el anión O3-(Cs+O3-). En estos compuestos d(O-O)= 1.35Å ligeramente mayores que en el O3.
Estructura electrónica del O3
El enlace en la molécula de trioxígeno puede interpretarse mediante la consideración de dos estructuras de resonancia. La distancia de enlace es menor que en un enlace sencillo, d(O-O) = 1.48Å, pero mayor que la de uno doble, d(O=O) = 1.21Å. El orden de enlace es 1 1/2
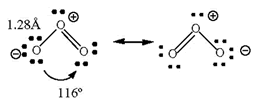
La teoría de orbitales moleculares da una mejor descripción de la molécula. Como en el caso del dioxígeno la separación energética entre los orbitales 2s y los 2p (~16 eV) justifica que los electrones 2s2 de todos los átomos de oxígeno no se consideren en el enlace. Por tanto tenemos que distribuir hasta doce electrones en nuestra molécula de trioxígeno.
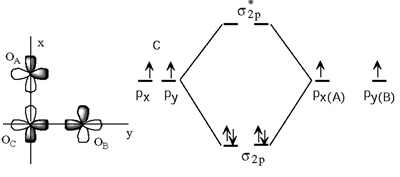
1.- Formación del esqueleto σ:
Para formar este esqueleto σ utilizamos dos electrones del átomo central y uno por cada átomo periférico.
2.- Formación de enlaces p: Los orbitales pz de los oxígenos mantienen un cierto solapamiento lateral. De la mezcla de los 3 OA de tipo pz se originan 3OM: uno enlazante, otro antienlazante y el tercero de no enlace. Los cuatro electrones p (dos del oxígeno central y otros dos de los oxígenos periféricos) llenan el orbital molecular π2py el πNB (de no enlace). Nos quedan dos pares de electrones pertenecientes esencialmente a los dos átomos periféricos que pueden alojarse en los orbitales py(A) y px(B) que son orbitales de no enlace.
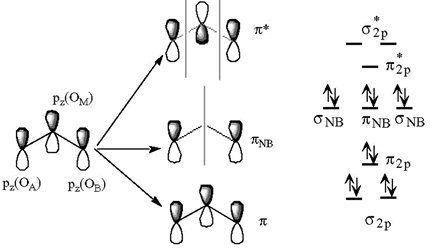
¿Cómo explicar el enlace O-O-O (~117º)?
El ángulo que se forma como consecuencia del esqueleto σ es de 90º. El mantenimiento de este ángulo tan cerrado tendría como consecuencia la existencia de fuertes repulsiones OA-OB lo cual es muy costoso energéticamente. Para minimizar estas repulsiones, el ángulo tiende a abrirse (minimizando las compresiones estéricas internas) pero al mismo tiempo se tiende a mantener lo más próximo posible al ángulo impuesto por los orbitales p (90º) que maximiza el solapamiento entre los orbitales que da lugar al enlace π.
Obtención y usos del ozono.
Una corriente de dioxígeno sobre un arco eléctrico de 10-20 kV provoca la disociación en oxígeno atómico que puede recombinarse por dos vías:
O + O → O2 ΔH= -496 kJ mol-1
O + O2 → O3 ΔH=-103 kJ mol-1
La segunda reacción es más rápida que la primera (su energía de activación es sólo 17 kJ mol-1) por lo que en la recombinación de los átomos de oxígeno se forma O3 en mayor proporción que O2. En el equilibrio se alcanza una concentración de O2 de alrededor de un 10%. El proceso global es un proceso endotérmico.
3 O2 → 2 O3, ΔHf=+143 kJmol-1
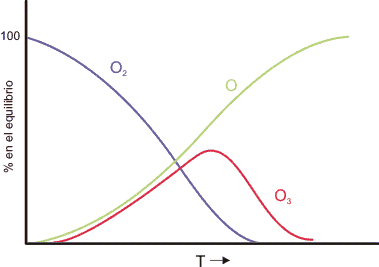
El ozono descompone lentamente para dar oxígeno. En la figura se muestra la proporción en el equilibrio delas tres formas en función de la temperatura. A temperaturas bajas la forma estable es el O2, a temperaturas elevadas el oxígeno atómico.
Una ruta alternativa de síntesis de ozono consiste en la irradiación ultravioleta del O2. Este método es muy útil cuando se requieren bajas concentraciones de O3 (esterilización de alimentos y desinfección).