Los potenciales normales son indicadores de cambios en condiciones estándar. Pero si se quiere estudiar la tendencia de una reacción es preciso conocer el signo y el valor de ΔG en dichas condiciones. Para obtener dicha información se utiliza la siguiente expresión termodinámica:
ΔG = ΔGº + RTlnQ
donde Q es el cociente de reacción:

aOxA + bRedB → a’RedA + b’OxB
La reacción será espontánea si DG < 0. Como DG = -nFE podemos transformar la expresión anterior de la forma siguiente:
-nFE = -nFEº + RTlnQ
E = Eº -(RT/nF)lnQ
Esta expresión es conocida como la ecuación de Nernst. La forma más utilizada de esta expresión, a 25 ºC, tras sustituir el valor numérico de las constantes es:
E = Eº -(0.059/n)logQ
El potencial de una reacción redox espontánea es positivo, E > 0, y su ∆G < 0. Para una reacción en equilibrio E = 0 (∆G = 0) y su cociente de reacción, Q, es igual a la constante de equilibrio, K:
E = 0 = Eº - (RT/nF)lnK => Eº = (RT/nF)lnK (∆Gº = -RTlnK)
Sobrepotencial
Como se señaló anteriormente, los factores termodinámicos se pueden usar tan sólo para predecir la espontaneidad de una reacción en unas determinadas condiciones. La Termodinámica no indica nada sobre la velocidad del proceso. Este punto es estudiado, como es bien sabido, por la Cinética Química.
Así, un potencial normal negativo de un par Mn+/M indica que la especie M puede reducir, de manera espontánea, al H+ a H2, o a cualquier especie oxidada de un par con un potencial más positivo, en condiciones normales. Pero no se puede predecir si la reacción transcurrirá a velocidades apreciables o no. No existen reglas que permitan predecir cuándo será probable que la reacción sea rápida. Sin embargo, hay una regla empírica útil (que encuentra numerosas excepciones) que dice que “los pares con potenciales inferiores a –0.6 V pueden reducir al ion H+a H2 a velocidad apreciable”. Esta regla se puede ampliar diciendo que una reacción redox se producirá a una velocidad apreciable siempre que su potencial sea superior a 0.6 V. Por ejemplo para que se pueda producir la reacción de oxidación del agua a tal velocidad
| O2 (g) + 4H+(ac) + 4e- → 2 H2O (l) | ERedº = +1.23 V |
| 2 H2O (l) → O2 (g) + 4H+(ac) + 4e- | Eoxº = -1.23 V |
se necesita un par redox cuyo potencial sea de Eº = 1.23 + 0.6 = 1.83 V.
Como se puede observar, la regla dicta que se necesita una diferencia entre los dos potenciales de reducción de los pares redox implicados de 0.6 V. Este valor de potencial en exceso se denomina sobrepotencial. La existencia de este sobrepotencial explica por qué ciertos metales reducen al H+ en medio ácido y no en agua a pH neutro. Tales metales (entre los que se encuentra el Fe y el Zn) poseen potenciales de reducción negativos, pero no poseen un valor suficientemente grande como para conseguir un sobrepotencial de –0.6 V para la reducción del H+ a pH = 7.
Ejemplo: reducción del H+ por Fe(s).
La ecuación de Nernst para el hidrógeno, a P = 1atm, es:
H+ (ac) + e- → ½ H2 (g)
E = Eº - (0.059/1)log (1/[H+])
↓ Eº = 0
E = 0.059log[H+] = -0.059pH
↓ pH = 7
E = -0.41
Suponiendo que el par redox Fe2+/Fe se encuentra en condiciones estándar, Eº = -0.44 V. Luego
ER = -0.41 - (-0.44) = 0.03 V
Como 0.03 << 0.6 V, se puede predecir que la reacción será lenta.
Estabilidad de los Pares Redox
Un ion o molécula en disolución puede ser inestable al sufrir reacciones de oxido-reducción, debido a la presencia de cualquiera de las otras especies presentes en disolución, o incluso al mismo disolvente. Cuando el disolvente empleado es H2O, éste puede actuar como agente reductor, liberando O2 (se oxida el ion O2-), o como oxidante produciendo H2 (el H+ se reduce). Las especies que pueden existir en H2O poseen potenciales de reducción que se encuentran entre los límites definidos por estos dos procesos:
↑ Especies que oxidan al H2O |
|
| O2 (g) + 4H+(ac) + 4e- → 2 H2O (l).... | Eº = +1.23 V |
Especies Estables en H2O |
|
| 2H+(ac) + 2e- → H2 (g).......................... | Eº = 0 V |
↓ Especies que reducen al H+ |
Especies oxidadas por el H2O
La oxidación de los metales por el agua o por los ácidos en medio acuoso, generalmente, responde al siguiente tipo de proceso:
M(s) + H2O (l) → M+ (ac) + ½ H2 (g) + OH- (ac)
M(s) + H+ (ac) → M+ (ac) + ½ H2 (g)
Estos procesos son termodinámicamente favorables cuando el metal, M, es un elemento del bloque s, distinto del berilio, o un metal de la primera parte (Grupos 4-7: Ti, V, Cr, Mn) de la primera serie de transición. Algunos metales pueden sufrir reacciones semejantes, pero transfieren un número de electrones superior
2Sc(s) + 6H+ (ac) → 2Sc3+ (ac) + 3H2 (g)
De manera general, cuando el potencial normal de reducción de un ion metálico a metal es negativo, el metal se oxida en un ácido 1M, con desprendimiento de H2. Sin embargo, como ya se ha comentado anteriormente, la reacción puede ser lenta. Por ejemplo, las reacciones del Mg y del Al con el aire húmedo son espontáneas, pero estos metales se pueden usar durante años en presencia de H2O y oxígeno. No se atacan por oxígeno porque se pasivan, es decir, se recubren de una capa impermeable de óxido que los aisla del exterior e impide que progrese la reacción de oxidación. Este fenómeno de pasivado también ocurre en los metales como el Fe, Cu y Zn.
Especies reducidas por el H2O
El agua puede actuar como reductora mediante la semirreacción:
2 H2O (l) → O2 (g) + 4H+(ac) + 4e- Eº = -1.23 V
O2 (g) + 4H+(ac) + 4e- → 2 H2O (l) Eº = 1.23 V
Como se observa, este potencial muy positivo muestra que el H2O se comporta como un reductor muy débil, excepto frente a agentes oxidantes enérgicos como por ejemplo el ion Co3+ (ac), para el que Eº(Co3+/Co2+) = +1.82 V. Este ion se reduce en H2O con liberación de O2.
4Co3+ (ac) + 2H2O (l) → 4Co2+ (ac) + O2 (g) + 4H+ (ac)
Eº = Eº(Co3+/Co2+) – Eº(H+,O2/H2O) = -0.59 V
Este valor de Eº es muy próximo al valor del sobrepotencial necesario para que la velocidad de reacción sea significativa. Como se producen H+ en la reacción, un cambio de pH desde neutro a pH altos favorece la reacción.
Existen otros sistemas como el Ce4+/Ce3+ (1.61 V), Cr2O72-/Cr3+ (+1.33 V, medio ácido) y MnO4-/Mn2+ (1.51 V, en medio ácido), para los que no se alcanza el sobrepotencial, y son estables en disolución acuosa, aunque para todos ellos DGº < 0. El origen de esta dificultad del agua para actuar como reductor reside en la necesidad de transferir cuatro electrones a fin de un doble enlace oxígeno-oxígeno.
Campo de estabilidad del H2O
Un agente reductor capaz de reducir al agua a H2 o un agente oxidante capaz de oxidarlo a O2 se descompondrá en disolución acuosa. El campo de estabilidad del agua se define como el intervalo de valores del potencial de reducción y de pH para el que el H2O es termodinámicamente estable a la reducción y a la oxidación. Los límites superior e inferior del campo de estabilidad se identifican hallando la dependencia de E con el pH para las semirreacciones correspondientes:
H2O actuando como reductor
Semirreacción del par: O2 (g) + 4H+(ac) + 4e- → 2 H2O (l) ..........Eº = 1.23 V
n = 4.................Q = 1/PO2[H+]4
↓
E = Eº + (RT/4F)ln(PO2[H+]4)
↓PO2 = 1 atm, 25 ºC
E = 1.23 – 0.059pH
Cualquier especie con un potencial de reducción más alto que este valor puede ser reducida por el agua, liberándose O2. Éste es el límite superior del campo de estabilidad del H2O como reductor.
H2O como oxidante:
La reducción del H+ (ac) a H2 se produce mediante la siguiente semirreacción:
2H+(ac) + 2e- → H2 (g)
Eº = 0, n = 2, Q =PH2/[H+]2
de donde,
E = Eº - (RT/2F)ln(PH2/[H+]2)
Si PH2 = 1 y t = 25 ºC,
E = -0.059pH
Cualquier especie con un potencial de reducción inferior a este valor puede reducir al H+(ac) a H2, por lo que éste es el límite inferior del campo de estabilidad.
La Figura 2 muestra el campo de estabilidad del agua. El eje vertical representa el Eº de reducción de los pares redox en agua: Los que caen por encima de la línea superior pueden oxidar al agua; aquellos que caen por debajo del línea inferior pueden reducir al agua. La zona sombreada representa la zona de estabilidad del agua pura.
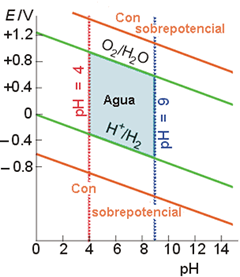
Figura 2. Campo de estabilidad del agua
Desproporción
Como Eº(Cu+/Cu) = +0.52 V y Eº(Cu2+/Cu+) = 0.16 V ambos potenciales se encuentran dentro del campo de estabilidad del H2O y, por lo tanto, los iones Cu+ no oxidarán ni reducirán al agua. Sin embargo, el Cu(I) no es estable en disolución acuosa porque sufre una desproporción, que consiste en una reacción en la que el número de oxidación del elemento aumenta y disminuye. Es decir, el elemento que se desproporciona actúa como oxidante y como reductor al mimo tiempo:
2 Cu+ (ac) ![]() Cu2+ (ac) + Cu (s)
Cu2+ (ac) + Cu (s)
Esta reacción es espontánea ya que el Eº = Eº( Eº(Cu+/Cu) - Eº(Cu2+/Cu+) = 0.36 V. Empleando la ecuación Eº = + (RT/nF)lnK, se puede tener una idea de la posición del equilibrio.
0.36 = (0.059/n)logK, n = 1 => K = 1.3x106
El elevado valor de la constante indica que la reacción está muy desplazada a la derecha.
El ácido hipocloroso también está sometido a la desproporción:
5 HClO (ac) → 2 Cl2 (g) + ClO3- (ac) + 2H2O (l) + H+ (ac)
esta reacción es la suma de dos semirreacciones :
4 HClO (ac) + 4H+ (ac) + 4e- → 2 Cl2 (g) + 4H2O (l) .........Eº = +1.63 V
ClO3- (ac) + 5H+ (ac) + 4e- →HClO (ac) + 2H2O (l)............Eº = +1.43 V
Eº = +1.63 –1.43 V = 0.20 V, K = 3x1013
La reacción inversa a la desproporción es la comproporción. En esta reacción, dos especies del mismo elemento en estado de oxidación diferentes forman un producto en el que el elemento se encuentra en un estado de oxidación intermedio:
Ag2+ (ac) + Ag (s) → 2Ag+ (ac)........Eº = +1.18 V, Eº > 0 (proceso espontáneo)
K = 9x1019