Introducción
El amoníaco es un compuesto químico cuya molécula está compuesta por un átomo de nitrógeno (N) y tres átomos de hidrógeno (H) y cuya fórmula química es NH3.
El nombre de amoníaco deriva del nombre dado a una divinidad egipcia: Amón. Los egipcios preparaban un compuesto, cloruro amónico, a partir de la orina de los animales en un templo dedicado a este Dios. Cuando se llevo a Europa mantuvo ese nombre en recuerdo de la sal de Amón.
Propiedades físico químicas del amoníaco
- Gas incoloro en condiciones normales
- Temperatura de solidificación –77,7ºC
- Temperatura normal de ebullición –33,4ºC
- Calor latente de vaporización a 0ºC 302 kcal/kg
- Presión de vapor a 0ºC 4,1 atm.
- Temperatura crítica 132,4ºC
- Presión crítica 113atm.
- Densidad del gas (0ºC y 1atm.) 0,7714 g/l
Efectos tóxicos
Es tóxico por inhalación (edema pulmonar) y los vapores producen irritación de ojos. Las salpicaduras de amoníaco líquido producen quemaduras y un daño irreparable en los ojos.
Almacenamiento
El amoníaco se puede almacenar en almacenamientos refrigerados a presión atmosférica y aproximadamente –33ºC con capacidades de 10000 a 30000 tn (hasta 50000)
También puede almacenarse en esferas o tanques a presión a temperatura ambiente y su presión de vapor con capacidades de hasta 1700 tn.
Por ultimo se utilizan esferas semirefrigeradas a presiones intermedias (4atm) y 0ºC estas esferas también tienen capacidades intermedias entre los almacenamientos a temperatura ambiente y los refrigerados.
Síntesis industrial
El NH3 se obtiene exclusivamente por el método denominado Haber-Bosh (Fritz Haber y Carl Bosh recibieron el Premio Nobel de química en los años 1918 y 1931). El proceso consiste en la reacción directa entre el nitrógeno y el hidrógeno gaseosos
N2 (g) + 3 H2 (g) ![]() 2 NH3 (g) ΔHº = -46,2 kj/mol
2 NH3 (g) ΔHº = -46,2 kj/mol
ΔSº < 0
es una reacción exotérmica por lo que un excesivo aumento de temperatura no favorece la formación de amoníaco
25 ºC K = 6,8.105 atm.
450 ºC K = 7,8.10-2 atm.
Sin embargo, la velocidad a la que se forma NH3 a temperatura ambiente es casi nula. Es una reacción muy lenta, puesto que tiene una elevada energía de activación, consecuencia de la estabilidad del N2. La solución de Haber al problema fue utilizar un catalizador (óxido de hierro que se reduce a hierro en la atmósfera de H2) y aumentar la presión, ya que esto favorece la formación del producto. Convertir el método de Haber en un proceso de fabricación fue trabajo realizado por Carl Bosh, ingeniero químico de la BASF, quien de este modo consiguió su nobel.
En la práctica las plantas operan a una presión de 100-1000 atm. y a una temperatura de 400-600 atm. En el reactor de síntesis se utiliza α-Fe como catalizador (Fe2O3 sobre AlO3![]() catálisis heterogénea). A pesar de todo, la formación de NH3 es baja con un rendimiento alrededor del 15%. Los gases de salida del reactor pasan por un condensador donde se puede licuar el NH3 separandolo así de los reactivos, los cuales pueden ser nuevamente utilizados.
catálisis heterogénea). A pesar de todo, la formación de NH3 es baja con un rendimiento alrededor del 15%. Los gases de salida del reactor pasan por un condensador donde se puede licuar el NH3 separandolo así de los reactivos, los cuales pueden ser nuevamente utilizados.
Los estudios sobre el mecanismo de la reacción indican que la etapa determinante de la velocidad de la reacción es la ruptura de la molécula de N2 y la coordinación a la superficie del catalizador. El otro reactivo, H2, se activa más fácilmente. Se producen una serie de reacciones de inserción entre las especies adsorbidas para producir el NH3.
El catalizador funciona adsorbiendo las moléculas de N2 en la superficie del catalizador debilitando el enlace interatómico N-N; de esta forma se origina N atómico el cual reacciona con átomos de hidrogeno que provienen de la disociación de H2 que también tiene lugar en la superficie metálica.
Horno de síntesis
El comportamiento del acero frente al hidrógeno a altas presión y temperatura es un factor determinante para la construcción de un horno de síntesis.
El hierro a elevadas temperatura y presión es permeable al hidrógeno, que en estas condiciones es capaz de eliminar al carbono con formación de hidrocarburos. Con esto el acero pierde resistencia y después de un cierto tiempo de funcionamiento el horno puede rajarse y explotar. Para impedirlo se construye el horno con hierro dulce pobre en carbono. Este apenas tiene resistencia a la presión y tampoco puede evitar que el H2 se difunda a través, pero estas dificultades pueden salvarse si se reviste este tubo con un segundo de acero al cromo-níquel , resistente a la presión y se procura simultáneamente que el hidrógeno que se difunda a través del primero se pueda eliminar del espacio entre ambos con facilidad y a baja presión.
Existen numerosos métodos en la síntesis actual del amoniaco, pero todos ellos derivan del proceso Haber-Bosch original. Las modificaciones más importantes están relacionadas con la fuente del gas de síntesis, la diferencia en los procesos de preparación del gas de síntesis y las condiciones de obtención del amoniaco.
La producción de una planta de NH3 ronda las 1500 tn./día.
La fabricación de amoníaco constituye uno de los ejemplos de la industria química pesada.
Materias primas
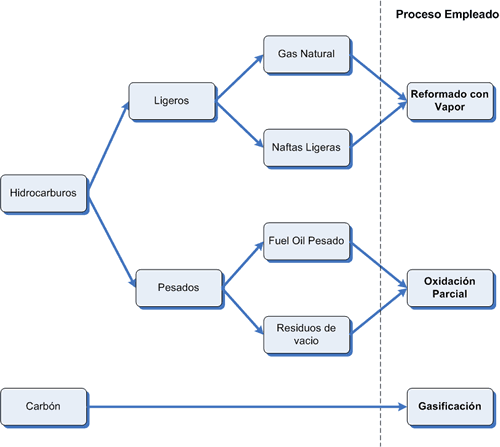
El 77% de la producción mundial de amoniaco emplea Gas natural como materia prima.
El 85% de la producción mundial de amoniaco emplea procesos de reformado con vapor.
Gas natural |
Fuel oil pesado |
Carbón |
|
|---|---|---|---|
| Consumo de energía | 1,0 |
1,3 |
1,7 |
| Coste de inversión | 1,0 |
1,4 |
2,4 |
| Coste de producción | 1,0 |
1,2 |
1,7 |
Las previsiones son que el gas natural siga siendo la materia prima principal durante por lo menos los próximos 50 años.