La química orgánica, se basa en la relación entre estructura molecular y propiedades.
La estereoquímica (del griego stereos, sólido) es la parte de la química que se ocupa del de las estructuras en tres dimensiones. Estudia la disposición espacial de los átomos que componen las distintas moléculas y como afecta esta disposición a las propiedades y reactividad de dichas moléculas.
Un aspecto de la estereoquímica es la estereoisomería. Los isómeros son compuestos diferentes que tienen la misma fórmula molecular. Es decir poseen la misma proporción de átomos que los conforman, pero presentan estructuras moleculares diferentas.
La clase particular de isómeros que sólo se diferencian por la orientación espacial de sus átomos (pero que son iguales entre sí en cuanto a qué átomos están unidos a cuáles otros) se llama estereoisómeros.
La existencia de tales isómeros nos proporciona una de nuestras medios mas importantes para la exploración de mecanismos de reacciones químicas; muy a menudo, se selecciona una de estos isómeros para un estudio, no por que sea diferente de los compuestos ordinarios en su química tridimensional, sino porque puede revelar lo que las sustancias corrientes ocultan y, nuevamente, a pesar de su gran semejanza, un isómero de tal pareja puede servir de alimento nutriente, como antibiótico o como un poderoso estimulante cardiaco, mientras que el otro puede ser inútil.
Actividad óptica, Luz polarizada
La luz posee ciertas propiedades que se comprenden mejor si se considera como un fenómeno ondulatorio, cuyas vibraciones son perpendiculares a la dirección de su desplazamiento. Hay un número infinito de planos que pasan por la línea de propagación y la luz ordinaria vibra en todos estos planos. Consideremos que se está mirando de frente una linterna, todas ellas perpendiculares a una línea entre nuestros ojos y el papel (linterna). La luz polarizada en un plano es luz cuyas vibraciones ocurren en uno solo de sus planos posibles. La luz ordinaria se convierte en polarizada haciéndola pasar a través de una lente hecha del material conocido como Polaroid o, más tradicional, por trozos de calcita (una forma cristalina particular del CaCO3), dispuestos de forma que constituyen lo que se conoce como un prisma de Nicol.
Una sustancia ópticamente activa es la que rota el plano de la luz polarizada. Cuando se hace pasar luz polarizada, vibrando en un plano determinado, por una sustancia ópticamente activa, emerge vibrando en un plano diferente. Esta propiedad es medida por medio de un polarímetro.
Enantiomería
La actividad óptica fue descubierta en 1815 por el físico Jean-Baptiste Biot.
En 1848, el químico Louis Pasteur mientras estaba realizando un trabajo sobre sales del ácido tartárico, observó que, el tartrato de sodio y amonio, ópticamente inactivo, existía como una mezcla de dos clases diferentes de cristales que eran imágenes especulares entre sí. Separó la mezcla cuidadosamente en dos montones uno de cristales derechos y el otro de izquierdos.
La mezcla original era ópticamente inactiva; sin embargo, cada grupo de cristales por separado era ópticamente activo. Además, las rotaciones específicas de ambas soluciones eran iguales, pero de signo contrario; es decir, una solución rotaba la luz polarizada en un plano hacia la derecha y, la otra, un número igual de grados hacia la izquierda. En todas las demás propiedades, ambas sustancias eran idénticas.
Moléculas Quirales
Los isómeros que son imágenes especulares (una es la imagen en el espejo de la otra) se llaman enantiómeros. Estas moléculas no son superponibles con sus imágenes especulares; es decir, son quirales.

Los enantiómeros tienen propiedades físicas idénticas, excepto por la dirección en la que desvían la luz polarizada. Un ejemplo, son los 2-metil-1-butanoles, éstos tienen idénticos puntos de fusión y ebullición, densidades, etc. pero uno rota la luz polarizada en un plano a la derecha, y el otro, a la izquierda.
Las propiedades químicas de los enantiómeros también son idénticas, excepto cuando se hacen reaccionar con compuestos ópticamente activos. Si se comparan las velocidades de reacción de los dos enantiomeros estas son iguales; sin embargo, muchas veces los productos que se forman no son idénticos, sino que son enantiomeros entre si.
Drogas Quirales
Las moléculas quirales tienen un sin fin de aplicaciones, principalmente dentro de la bioquímica. En la industria farmacéutica la mayoría de los medicamentos se basan en este tipo de moléculas, donde la mayoría de las medicinas se componen de mezclas racemicas, es decir mezclas de enantiomeros en igual proporción.
Por otro lado esto puede llegar a ser un problema ya que mientras que un enantiómero puede tener un efecto benéfico en el organismo, la otra forma enantiomerica puede ser dañina o simplemente no causar efecto alguno. Debido a este problema la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) ha propuesto y exigido a todos los fabricante de medicamentos realizar investigaciones sobre las propiedades de cada enantiomero a ser usados en las drogas que existen en el mercado. De esta forma solo se podrán comerciar medicamentos que contengan un solo enantiomero con lo que se desea reducir los efectos secundarios causados por los medicamentos.
Un ejemplo se puede observar en la dexenfluramina (1), es un medicamento anti-obesidad el cual fue aprobado en 1996 que presenta varia ventajas en comparación a la mezcla racémica de la cual proviene entre ellas la reducción de los efectos secundarios.
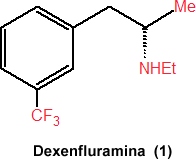
Anteriormente la mayoría de las drogas sintéticas no eran quirales, sin embargo las que se derivan de productos naturales los son por ejemplo la penicilina. Considerando que en la producción de medicamentos se busca la mayor efectividad posible es necesario aplicar procesos más complejos. Una prueba de esto sería el hecho de que actualmente se requieren más de doce pasos para la síntesis de un medicamento a base de compuestos orgánicos, mientras que años atrás seis eran suficientes.
Los medicamentos, constituidos de un sólo isómero actúan de una manera mucho más específica en comparación a las mezcla racémicas de la que provienen. Además, los avances tecnológicos contribuyen a que la separación de enantiomeros sea una opción factible.
Hay principalmente tres opciones para la obtención de enantiomeros simple:
Obtención a partir de fuentes naturales
El primero y el más simple consiste en obtener los enantiomeros a partir de fuentes naturales, ya sea de microorganismos, plantas o animales. Un ejemplo es el Taxol, que es una droga anti - cáncer y que se obtiene de un árbol. La complejidad estructural de ésta molécula hace que la síntesis química sea impráctica para la fabricación de medicamentos a nivel industrial. Sin embargo, es posible unir una cadena sintética que contenga el agente activo del Taxol a otro compuesto más abundante en la fuente de la que se obtiene, en este caso al Baccatin III.
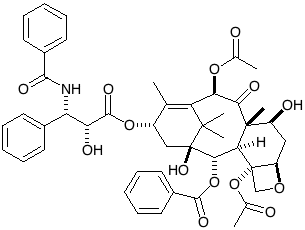
Taxol
Obtención a partir de mezclas racémicas
Las mezclas racémicas son fáciles de hacer y existen muchas maneras de separarlas en enantiomeros. La resolución clásica utiliza un ácido o base quiral que forma una sal con la mezcla racémica.
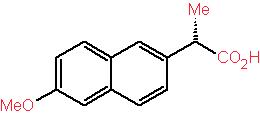
Naproxeno
Muchos medicamentos son hechos de ésta forma. El Naproxeno,
por ejemplo, se obtiene usando una alcaliglucamina como agente de resolución.
Los dos métodos presentados anteriormente requieren cantidades estequiométricas de otro agente, pero el método de resolución se puede realizar directamente por medio de métodos físicos.
Otras separaciones físicas similares pueden ser realizadas por sistemas de extracción o de membranas, en las que una fase contiene la muestra racémica y la otra contiene un selector quiral, el cual extrae uno de los enantiomeros.
Las resolución puede ser efectuada mediante la conversión de uno de los dos enantiomeros en otro compuesto, este proceso se conoce como resolución cinética. En este tipo de resoluciones generalmente se utilizan reagentes quirales o catalizadores, aunque en el caso de medicamentos esto no es muy funcional.
Métodos asimétricos
La forma más usual de síntesis asimétrica se hace tomando un sustrato planar (sin elementos quirales y se transforma vía asimétrica en un compuesto quiral. Esto tiene la ventaja de que todo el material puede ser transformado directamente al enantiomero requerido.
Un ejemplo de este método es la hidrogenación asimétrica utilizada con Difosfíto de Rodio como catalizador para elaborar el Levodopa que es un medicamento utilizado para tratar el mal de Parkinson.
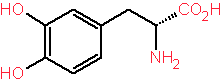
Levodopa
La mayoría de las reacciones asimétricas son reducciones, oxidaciones o otro tipo de reacciones en las que se forman enlaces, ya sea por medios catalíticos o estequiométricos.
La fabricación de medicamentos a base de un sólo enantiomero constituye un avance muy importante en lo que a salud respecta. En un futuro cercano todos los medicamentos serán producidos de ésta forma. Más aún esta filosofía se extenderá a otras áreas de la química igualmente importantes como la producción de herbicidas, por ejemplo.