Introducción
Con el crecimiento de la población mundial la demanda de agua dulce a aumentado, si sumamos ha esto el crecimiento industrial, el tratamiento de aguas y efluentes se ha transformado en algo importantísimo para el desarrollo de esta sociedad. Es por esta razón que se ha declarado al agua como un recurso escaso, de acuerdo a la ubicación y recursos económicos de los distintos países, estos adoptan distintas técnicas de tratamientos de efluentes y aguas. Por ejemplo, en países donde la energía es barata, se opta por tratamientos como la evaporación de aguas salobres, en otros países ricos en aguas subterráneas se opta por el tratamiento de intercambio iónico. Con el desarrollo de la tecnología actual, se han creado nuevas alternativas para el tratamiento de aguas y efluentes, esta alternativa es la osmosis inversa la cual a tenido un desarrollo masivo en el campo de la desalación de aguas salobres, sobre todo en el campo industrial, reemplazando o complementando a los métodos anteriores, ya que es un método no excluyente de los otros. Y en algunos países se ha transformado en la única opción factible.
En el presente trabajo explicaremos en que consiste esta técnica, algunas de sus aplicaciones, las ventajas y desventajas respecto de los otros métodos existentes para tratamientos de aguas y se explicarán las condiciones en que opera la ósmosis inversa, la cual es solución para muchos de los problemas sobre abastecimientos de aguas y tratamiento de efluentes que hoy aquejan a poblaciones e industrias de todas partes del mundo.
Principio de la Osmosis Inversa
La Osmosis Inversa consiste en separar un componente de otro en una solución, mediante las fuerzas ejercidas sobre una membrana semi-permeable. Su nombre proviene de "osmosis", el fenómeno natural por el cual se proveen de agua las células vegetales y animales para mantener la vida.
En el caso de la Osmosis, el solvente (no el soluto) pasa espontáneamente de una solución menos concentrada a otra más concentrada, a través de una membrana semi-permeable. Entre ambas soluciones existe una diferencia de energía, originada en la diferencia de concentraciones. El solvente pasará en el sentido indicado hasta alcanzar el equilibrio. Si se agrega a la solución más concentrada, energía en forma de presión, el flujo de solvente se detendrá cuando la presión aplicada sea igual a la presión Osmótica Aparente entre las 2 soluciones. Esta presión Osmótica Aparente es una medida de la diferencia de energía potencial entre ambas soluciones. Si se aplica una presión mayor a la solución más concentrada, el solvente comenzará a fluir en el sentido inverso. Se trata de la Osmosis Inversa. El flujo de solvente es una función de la presión aplicada, de la presión osmótica aparente y del área de la membrana presurizada.
Los componentes básicos de una instalación típica de osmosis inversa consisten en un tubo de presión conteniendo la membrana, aunque normalmente se utilizan varios de estos tubos, ordenados en serie o paralelo. Una bomba suministra en forma continua el fluido a tratar a los tubos de presión, y, además, es la encargada en la práctica de suministrar la presión necesaria para producir el proceso. Una válvula reguladora en la corriente de concentrado, es la encargada de controlar la misma dentro de los elementos (se denominan así a las membranas convenientemente dispuestas).
Hoy en día, hay 3 configuraciones posibles de la membrana: el elemento tubular, el elemento espiral y el elemento de fibras huecas. Más del 60% de los sistemas instalados en el mundo trabajan con elementos en espiral debido a 2 ventajas apreciables:
- Buena relación área de membrana/volumen del elemento.
- Diseño que le permite ser usado sin dificultades de operación en la mayoría de las aplicaciones, ya que admite un fluido con una turbiedad más de 3 veces mayor que los elementos de fibra hueca.
Este elemento fue desarrollado a mediados de la década del 60, bajo contrato de la oficina de aguas salinas. En la actualidad estos elementos se fabrican con membranas de acetato de celulosa o poliamidas y con distinto grados de rechazo y producción.
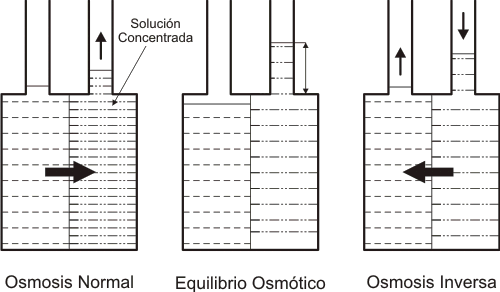
Figura: Principios de las Osmosis Normal e Inversa.
Aplicaciones de la Osmosis Inversa
Entre 1950 y 1970, se llevaron a cabo innumerables trabajos a fin de implementar el uso de la osmosis inversa en la desalación de aguas salobres y agua de mar.
A partir de 1970, esta técnica comenzó a ser competitiva, y en muchos casos superior a algunos de los procesos y operaciones unitarios usados en concentración, separación y purificación de fluidos. Hay razones para justificar esta creciente supremacía, ya que la osmosis inversa reúne características de excepción, como:
- Permite remover la mayoría de los sólidos (inorgánicos u orgánicos) disueltos en el agua (hasta el 99%).
- Remueve los materiales suspendidos y microorganismos.
- Realiza el proceso de purificación en una sola etapa y en forma continua.
- Es una tecnología extremadamente simple, que no requiere de mucho mantenimiento y puede operarse con personal no especializado.
- El proceso se realiza sin cambio de fase, con el consiguiente ahorro de energía.
- Es modular y necesita poco espacio, lo que le confiere una versatilidad excepcional en cuanto al tamaño de las plantas: desde 1 m3/día, a 1.000.000 m3/día.
La osmosis inversa puede aplicarse en un campo muy vasto y entre sus diversos usos podemos mencionar:
- Abastecimiento de aguas para usos industriales y consumo de poblaciones.
- Tratamiento de efluentes municipales e industriales para el control de la contaminación y/o recuperación de compuestos valiosos reutilizables.
- En la industria de la alimentación, para la concentración de alimentos (jugo de frutas, tomate, leche, etc.).
- En la industria farmacéutica, para la separación de proteínas, eliminación de virus, etc.
Se han efectuado numerosas experiencias para concentrar y purificar líquidos y gases. No obstante, las aplicaciones más difundidas son las que trataremos a continuación.
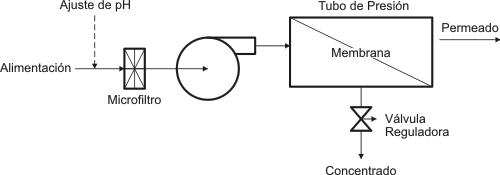
Figura: Esquema básico de un sistema de ósmosis inversa.
Rechazo de Membranas
Inorgánicos
| Cationes | Aniones | ||||
|---|---|---|---|---|---|
| Nombre | Símbolo |
%Rechazo |
Nombre | Símbolo |
%Rechazo |
| Sodio | Na+ |
94-96 |
Cloruro | Cl- |
94-95 |
| Calcio | Ca++ |
96-98 |
Bicarbonato | HCO3- |
95-96 |
| Magnesio | Mg++ |
96-98 |
Sulfato | SO4- |
99+ |
| Potasio | K+ |
94-96 |
Nitrato | NO3- |
93-96 |
| Hierro | Fe++ |
98-99 |
Fluoruro | F- |
94-96 |
| Manganeso | Mn++ |
98-99 |
Silicato | SiO2- |
95-97 |
| Aluminio | Al+++ |
99+ |
Fosfato | PO4- |
99+ |
| Amonio | NH4+ |
88-95 |
Bromuro | Br- |
94-96 |
| Cobre | Cu++ |
96-99 |
Borato | B4O7- |
35-70** |
| Níquel | Ni++ |
97-99 |
Cromato | CrO4- |
90-98 |
| Estroncio | Sr++ |
96-99 |
Cianuro | CN- |
90-95** |
| Cadmio | Cd++ |
95-98 |
Sulfito | SO3- |
98-99 |
| Plata | Ag+ |
94-96 |
Tiosulfato | S2O3- |
99+ |
| Arsénico | As+++ |
90-95 |
Ferrocianuro | Fe(CN)6- |
99+ |
Orgánicos
Nombre |
Peso Molecular |
%Rechazo |
|---|---|---|
| Sucrosa | 342 |
100 |
| Lactosa | 360 |
100 |
| Proteínas | Mayor
10.000 |
100 |
| Glucosa | 198 |
99,9 |
| Fenol | 94 |
93-99** |
| Acido Acético | 60 |
65-70 |
| Tinturas |
|
100 |
| Demanda bioquímica de oxígeno (DBO) | ----- |
90-99 |
| Demanda química de oxígeno (COD) | ----- |
80-95 |
| Urea | 60 |
40-60 |
| Bacterias y Virus | 5.000-100.000 |
100 |
| Pirógenos | 1.000 -
5.000 |
100 |
** Depende del pH.
Tabla I: Rechazo de Membranas