El nitrógeno fue reconocido como sustancia independiente en 1772, por el botánico escocés D. Rutherford, de la universidad de Edimburgo, quién demostró que era incapaz de sostener la vida ni la combustión. Lavoisier lo denominó aire mefítico, y más tarde ázoe (sin vida). J. A. Chaptal en 1823, propuso el nombre de nitrógeno, debido a la presencia de este elemento en el nitre (salitre, KNO3), sustancia muy conocida.
El nitrógeno constituye el 78 % en volumen de la atmósfera. En 1942, se tuvo noticia de un pozo de gas, existente en wyoming, que suministra nitrógeno puro, y que se ha cerrado para servirse de él más adelante. El nitrógeno es también abundante en estado de combinación. Los principales compuestos naturales salinos son el salitre y el nitrato de sodio o Nitro de Chile. El nitrógeno es un elemento esencial en las proteínas de todos los animales y plantas. También se encuentra en la naturaleza en forma de amoníaco y sales amónicas, como resultado de la destrucción de la materia orgánica nitrogenada (putrefacción de materia natural y animal).
Obtención de nitrógeno.
a) a partir del aire. El nitrógeno puede obtenerse del aire por simple eliminación del oxígeno. En el laboratorio, haciendo pasar el aire arriba de cobre calentado, éste se apodera del oxígeno para formar óxido cúprico sólido, CuO. Si se quema fósforo en una campana invertida sobre agua se forma fósforo pentaoxidado sólido, que se disuelve en el agua y deja un residuo que en su mayor parte es nitrógeno. Otro método de obtención consiste en hacer burbujear aire en una solución alcalina de pirogalol, que absorbe al oxígeno.
En la industria el nitrógeno se obtiene a partir del aire líquido.
b) a partir de sus compuestos. El nitrógeno puede prepararse por oxidación del amoníaco, por lo cual se hace pasar este gas sobre óxido de cobre calentado al rojo.
2NH3 + 3CuO 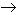 3H2O
+ N2 + 3Cu0
3H2O
+ N2 + 3Cu0
Un método más conveniente consiste en la descomposición del nitrito de amonio, NH4NO2. Este compuesto es inestable, y se descompone y se descompone fácilmente en agua y da nitrógeno. Cuando se calienta suavemente una disolución que contiene una mezcla de cloruro de amonio y nitrito de sodio, se desprende nitrógeno.
NH4+ + NO2 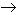 2H2O
+ N2.
2H2O
+ N2.
Amoníaco
Obtención
El amoníaco se obtiene por unión directa de los elementos, según el proceso HABER.
N2 +
3H2 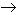 2NH3 +
21.880 calorías.
2NH3 +
21.880 calorías.
Esta reacción es reversible. De la ecuación termoquímica deducimos que el rendimiento del amoníaco disminuye al aumentar la temperatura (ley de Van't Hoff). A bajas temperaturas, la reacción es demasiado lenta para poder utilizarse prácticamente. En presencia de un catalizador, por ejemplo, una mezcla especial preparada con hierro, molibdeno y algo de óxido de aluminio, la combinación se acelera mucho. Pero incluso con el uso de un catalizador no podría aprovecharse industrialmente la reacción si no si no interviniera en ella otro factor: la presión. En la ecuación química anterior se observa que la formación de amoníaco va acompañada de una disminución del volumen, esto es, que cuatro volúmenes de la mezcla de hidrógeno y nitrógeno se convierten en dos de amoníaco. Por consiguiente, la reacción directa se ve favorecida por aumento de la presión (principio de Le Chatelier). Con el empleo de catalizadores, y regulando la temperatura y presión, es posible obtener rendimientos satisfactorios para la producción a gran escala.
| RENDIMIENTO |
TEMPERATURA |
PRESION |
| 15 % |
550-500°C |
200 atm. |
| 40 % |
450-500°C |
900 atm. |
El hidrógeno y el nitrógeno que se usan en este proceso deben ser puros al extremo para evitar el envenenamiento del catalizador. Después de pasar por éste, los gases se enfrían, y el amoníaco se separa licuándolo a presión o por absorción en agua. Los gases que quedan vuelven a la cámara catalítica para su ulterior tratamiento.
Ácido nítrico
Obtención
a) a partir del nitrato de sodio. En gran escala y en el laboratorio se obtiene ácido nítrico a partir del ácido sulfúrico concentrado y nitrato de sodio.
NaNO3 + H2SO4 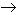 NaHSO4 + HNO3
NaHSO4 + HNO3
La reacción es reversible a temperaturas ordinarias, pero al calentar se desprende ácido nítrico en forma de vapor y el equilibrio se desplaza a la derecha. Los vapores se condensan en refrigerantes enfriados con agua, y el ácido se recoge en vasijas resistentes al mismo, por ejemplo, de vidrio o de gres. El ácido obtenido es de color amarillo por la presencia de óxidos de nitrógeno que se forman al descomponerse aquel. Al hacer pasar una corriente de aire por el destilado se eliminan los óxidos y se mantiene el producto incoloro.
b) a partir del amoníaco. Un método mucho más importante para la producción de ácido nítrico es la oxidación catalítica del amoníaco, realizada por Wilhelm Ostwald (1853-1932). Se mezcla amoníaco procedente del proceso Haber o del de la Cianamída, con unas diez veces su volumen de aire, calentado previamente a unos 600°C. La mezcla se pone en contacto con una malla de platino (catalizador). La reacción es exotérmica, y la temperatura asciende hasta unos 1000°C.
4NH3 + 5 O2 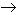 4NO
+ 6H2O + 215.000 calorías.
4NO
+ 6H2O + 215.000 calorías.
La mezcla permanece poco tiempo en contacto con el catalizador, aproximadamente 0,01 segundo, para evitar la oxidación del óxido nítrico. Luego se añade más aire, para bajar la temperatura de la mezcla y oxidar el óxido nítrico a dióxido de nitrógeno.
2NO + O2 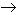 2NO2 +
27.800 calorías.
2NO2 +
27.800 calorías.
El dióxido de nitrógeno reacciona con el agua para formar ácido nítrico y óxido nítrico.
3NO2 + 3H2 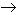 2H3+O
+ 2NO3- + NO
2H3+O
+ 2NO3- + NO
El óxido nítrico vuelve a la cámara de reacción y se oxida a dióxido de nitrógeno. La mayor parte de la producción de ácido nítrico se obtiene mediante este procedimiento.