Se denomina hidrocarburo a los compuestos orgánicos que contienen únicamente carbono e hidrogeno en sus moléculas. Conforman una estructura de carbono a la cual se unen átomos de hidrogeno.
Los hidrocarburos se clasifican en dos clases principales
- Hidrocarburos Aromáticos, los cuales tienen al menos un anillo aromático (conjunto planar de seis átomos de carbono)
- Hidrocarburos Alifáticos, se unen en cadenas abiertas, ya sea lineales o ramificadas.
Los Hidrocarburos Alifáticos a su vez se clasifican en:
- Hidrocarburos Saturados, también conocidos como alcanos , los cuales no tienen ningún enlace doble o triple entre los átomos de carbono.
- Hidrocarburos no Saturados, tienen uno o más
enlaces dobles o triples entre los átomos de carbono.
Según los enlaces sean dobles o triples se los clasifica en:- alquenos : contienen uno o más enlaces dobles
- alquinos : contienen uno o más enlaces triples
Alcanos
La familia más sencilla de este grupo es la de los alcanos que se caracteriza por la formula general (CnH2n+2). Por su estructura los alcanos se denominan también hidrocarburos saturados.
En una molécula de alcano los únicos enlaces químicos existentes son los sencillos entre átomos de carbono y entre átomos de carbono e hidrogeno. Debido a la gran estabilidad de estos enlaces los alcanos son poco reactivos, por lo cual se los denomina también parafinas.
Los alcanos se obtienen principalmente del petróleo y del gas natural, donde se encuentran mezclados como productos de la descomposición anaeróbica de la materia viva.
Combustión
2 CnH2n+2 +
3 (n+1) O2![]() 2nCO2 + 2(n+2) H2O + Calor
2nCO2 + 2(n+2) H2O + Calor
Reacción de sustitución
Bajo la influencia de la luz ultra violeta, o a 240-250 ≡C, el cloro o el bromo convierten los alcanos en cloroalcanos (cloruros de alquilo) o bromoalcanos (Bromuros de alquilo), formándose simultáneamente una cantidad equivalente de cloruro o bromuro de hidrogeno.
Mecanismo de halogenación:
Paso iniciador de la cadena
X2 ![]() 2X
2X
Pasos propagadores de la cadena
X· + RH ![]() HX
+ R·
HX
+ R·
R· + X2![]() RX
+ X·
RX
+ X·
Metano (CH4)
Tiene un átomo de carbono, cuyas 4 valencias se saturan con 4 átomos de hidrogeno.
Propiedades físicas:
Las moléculas de metano, en si, son no polares, ya que las polaridades de los enlaces carbono-hidrogeno individuales se anulan.
La atracción entre moléculas es limitada a las fuerzas de Van-der Waals, en consecuencia el metano es un gas a temperaturas ordinarias. El punto de fusión del metano es de -183 ≡C y su punto de fusión de -161,5 ≡C.
El metano es incoloro y, en estado sólido, menos denso que el agua (densidad relativa 0,4); es apenas soluble en agua, pero muy soluble en líquidos orgánicos, como la gasolina, éter y alcohol.
Combustión del metano
La llama de el metano es de color azul, debido a que la combustión con exceso de oxigeno es en general completa. El metano se oxida a CO2 y H2O pero si la combustión es incompleta se forma CO, H2O y un residuo carbonoso, llamado negro de humo.
CH4 + 2O2![]() CO2 +
2 H2O + calor (213 Kcal/mol)
CO2 +
2 H2O + calor (213 Kcal/mol)
Reacción con los halógenos:
A continuación se detallan los pasos del mecanismo de la cloración del metano.
Iniciación:
Cl2![]() 2Cl*
2Cl*
Propagación:
CH4 + Cl*![]() CH3* +
HCl
CH3* +
HCl
CH3* + Cl2![]() CH3Cl
+ Cl*
CH3Cl
+ Cl*
CH3Cl + Cl*![]() CH2Cl* +
HCl
CH2Cl* +
HCl
CH2Cl* + Cl2![]() CH2Cl2 +
Cl*
CH2Cl2 +
Cl*
CH2Cl2 + Cl* ![]() CHCl2* +
HCl
CHCl2* +
HCl
CHCl2* + Cl2![]() CHCl3 +
Cl*
CHCl3 +
Cl*
CHCl3 + Cl*![]() CCl3* +
HCl
CCl3* +
HCl
CCl3* + Cl2![]() CCl4 +
Cl*
CCl4 +
Cl*
Terminación:
2Cl* ![]() Cl2
Cl2
CH3* + Cl*![]() CH3Cl
CH3Cl
El petróleo y sus derivados.
El petróleo es esencialmente una mezcla de hidrocarburos que resultan de la descomposición de materias orgánicas de origen animal y vegetal; se encuentra localizado en yacimientos que se formaron durante los diferentes periodos geológicos.
El petróleo crudo es un líquido aceitoso, de color oscuro y de composición variable según los diferentes yacimientos; contiene principalmente hidrocarburos saturados, pero a veces también hidrocarburos no saturados, en particular aromáticos. La mezcla de compuestos que contiene el petróleo es muy compleja y se estima que son por lo menos 500.
Para obtener mayor provecho de le petróleo, se requiere de una destilación fraccionada denominada refinación.
En la refinación se separan las diferentes fracciones que se caracterizan por un intervalo definido de punto de ebullición. Se obtienen así los gases, las gasolinas, los querosenos, los gasóleos, los aceites lubricantes y los residuos sólidos como parafinas y asfaltos.
ALQUENOS
Introducción
A pesar de que los enlaces C - C sp3 - sp3 y los enlaces C - H sp3 - s son los más comunes y abundantes en los compuestos orgánicos, no son, notablemente, los que desempeñan el papel principal en las reacciones orgánicas. En la mayoría de los casos, son los enlaces p o los átomos distintos del carbono y del hidrógeno, los que le confieren a la .molécula su reactividad. Una zona de reactividad química en la molécula, recibe la denominación de grupo funcional. Dado que un enlace p o un átomo muy distinto en electronegatividad al carbono o al hidrógeno, pueden dar lugar a reacciones químicas, son considerados como grupos funcionales o como parte de un grupo funcional. Bajo esta óptica de grupos funcionales, podemos determinar, al doble enlace característico de los alqueno como uno, ya que es el que determina a las reacciones químicas.
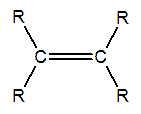
Grupo funcional de los alquenos
Un alqueno es un hidrocarburo con un doble enlace. Algunas veces a los alquenos también se los llama olefinas, nombre que procede de gas olefianta (gas formador de aceite), con el que se conocía antiguamente al etileno (CH2=CH2).
El doble enlace carbono-carbono es un grupo funcional bastante común en los productos naturales. Frecuentemente, el doble enlace se encuentra junto con otros grupos funcionales. Sin embargo, el doble enlace se encuentra junto con otros grupos funcionales y se encuentran a menudo en las plantas y en el petróleo. A continuación se dan dos interesante ejemplos de compuestos que se encuentran en la naturaleza y que contienen dobles enlaces carbono-carbono.
- Limoneno (de los aceites de cítricos.),
- 3-metilen-7,11-dimetil-1,6,10-dodecatrieno (compuesto secretado por los áfidos -pulgones- para señalar peligro a otros áfidos.).
Obtención de alquenos (eteno) a partir de un alcohol.
Los alcoholes sufren reacciones de sustitución y de eliminación en las que se rompe el enlace C - O.
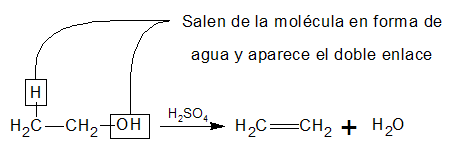
Estas reacciones de sustitución y de eliminación son similares a las de sustitución y eliminación de la de los halogenuros de alquilo. Sin embargo, los alcoholes se diferencian de los halogenuros de alquilo en que no dan reacciones de sustitución o eliminación en medio neutro o alcalino.
Combustión
El eteno arde con una llama amarillenta, índice de la presencia de una doble ligadura (esto indica la razón de la existencia de poco hidrógeno en comparación con la cantidad de carbono.).
H2-C=C-H2 +
O2![]() CO2 + H2O
CO2 + H2O
La ecuación anterior muestra una combustión completa, lo que generalmente no ocurre en el laboratorio. Se debe considerar entonces la posibilidad de la presencia de otros productos, según la siguiente ecuación:
H2-C=C-H2 +
O2![]() CO2 + CO + C + H2O
CO2 + CO + C + H2O
Reacción con permanganato de potasio
El reactivo más popular que se usa para convertir un alqueno en un 1,2 -diol, es una disolución acuosa, fría y alcalina, de permanganato de potasio (aún cuando este reactivo da bajos rendimientos). El tetraóxido de osmio da mejores rendimientos de dioles, pero el uso de este reactivo es limitado. La oxidación con permanganato de potasio, proceden a través de un éster inorgánico cíclico, el cual produce el diol cis si el producto es capaz de isomería geométrica.
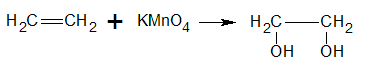
Reacción con Br2 en CCl4
Se produce la sustitución de un doble enlace en el eteno por bromo.
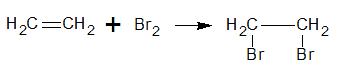
Alquinos
Los alquinos, también llamados acetilenos, son hidrocarburos que contienen un triple enlace carbono-carbono. El propio etino (también llamado acetileno), HC≡CH, que es el alquino más simple, alguna vez fue ampliamente usado en la industria como materia prima para la elaboración de acetaldehído, ácido acético, cloruro de vinilo y otros productos en grandes cantidades, pero ahora son más comunes otros procesos más eficientes en los que se utiliza eteno como materia prima. Sin embargo el acetileno se emplea todavía en la producción de polímeros acrílicos, y se elabora industrialmente por descomposición a alta temperatura (pirólisis) de metano. Este método no es de utilidad general en el laboratorio.
Se han aislado una gran cantidad de compuestos acetilénicos naturales en el reino vegetal. Por ejemplo, el triino siguiente se aisló del cártamo, Carthamus tinctorius, y evidentemente forma parte de las defensas químicas de la planta contra la infección por nemátodos
Propiedades del etino
Combustión del etino
En la combustión de etino se observa una llama amarillenta y fuliginosa, con bordes oscuros y gran cantidad de material en suspensión desprendida durante la combustión.
La llama amarillenta se debe a la baja proporción de hidrógeno en la molécula (debido al triple enlace) frente a la cantidad de carbono en la misma.
H-C ≡ C-H + O2![]() CO2 +
H2O
CO2 +
H2O
La ecuación anterior muestra una combustión completa, lo que generalmente no ocurre en la práctica corriente de laboratorio. Se debe tener, entonces, en cuenta la posibilidad de la presencia de monóxido de carbono y carbono nativo, según:
H-C ≡ C-H + O2![]() CO2 +
CO + C + H2O.
CO2 +
CO + C + H2O.
Reacción con solución amoniacal de nitrato de plata.
H-C ≡ C-H + Ag+![]() H-C ≡ C-Ag
H-C ≡ C-Ag
acetiluro de plata
Reacción con solución amoniacal de cloruro cuproso
H-C ≡ C-H + Cu+![]() H-C ≡ C-Cu
H-C ≡ C-Cu
acetiluro de cobre.
El acetiluro de cobre es un compuesto explosivo
Reacción con el reactivo de Baeyer
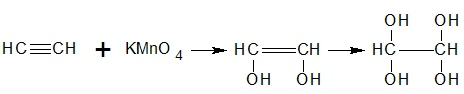
Reacción del etino con una solución alcalina de permanganato de potasio
Acidez de las triples ligaduras terminales.
Las triples ligaduras terminales, presentan un cierto carácter ácido, debido a que puede producirse la desprotonización, o pérdida de un hidrógeno del carbono primario y sustituirse por un catión sodio. El sodio, debido a su alta electropositividad deja a la estructura orgánica con densidad de carga negativa. Así, el etino actúa como un ácido, muy débil, pero capaz de desprotonizarse.