Reacciones de importancia para la industria
Veamos algunos aspectos del mecanismo de reacción radicalaria con algunos halógenos (violenta) y su oxidación a agua (combustión) que en grandes cantidades de H resulta ser explosiva y con compuestos orgánicos insaturados. Asimismo el método común de obtención industrial y sus usos comerciales más habituales atendiendo a su propia química.
| Iniciación | Br-Br => Br• + •Br |
Disociacióna ativada por luz o calor de las moléculas de dihalógeno para originar radicales que son los que propagan la reacción |
| Propagación | Br• + H2 => HBr + H• |
Una vez iniciada, la formación y destrucción de radicales se estabiliza y la produccion de HBr es muy rápida |
| Terminación | H• + •H => H2 |
Las reacciones de terminación se jacen más importantes cuandto menores son las concentraciones de H2 y Br2 |
| Reacción global | H2 (g) + Br2 (g) => 2HBr |
Con otros halógenos la reactividad desciende a lo largo del grupo, así pues con F es explosiva incluso a bajas temperaturas, con el Cl lenta en la oscuridad y catalizada por la luz y con el I esta termodinámicamente poco favorecida:
H2 (g) + F2 (g) ![]() 2HF (g)
2HF (g)
H2 (g) + Cl 2 (g) ![]() 2HCl (g)
2HCl (g)
H2 (g) + I 2 (g) ![]() 2HI (g)
2HI (g)
El H. reacciona con Oxigeno molecula r en un proceso molecular en el que se oxida a agua.
Esta combustión hace del H. un combustible muy interesante pues no hay productos relacionados con el efecto invernadero.
2H2 (g) + O2 (g) ![]() 2 H2O (g); ΔH = -928KJ
2 H2O (g); ΔH = -928KJ
Esta reacción esta entrópicamente desfavorecida pero entálpicamente favorecida. La gran energía del enlace O-H (464kJ/mol) compensa sobradamente el alto coste que supone la ruptura del enlace H-H y hace que esta reacción sea termodinámicamente posible. Si en la reacción interviene gran cantidad de H. la reacción es explosiva. Los sopletes O2/H2 consiguen gracias a esta reacción temperaturas de hasta 3000 ºC.
2H2 (g) + O2 (g) ![]() 2 H2O (g)
2 H2O (g)
El uso del H. de forma comercial más importante esta vinculado con la fijación del Nitrógeno, un conjunto de procesos por el cual, el N2 se capta de la atmósfera y se transforma en amoniaco, que a su vez es reactivo de partida para la síntesis de otros compuestos de interés comercial.
3H2 (g) + N2 (g) ![]() 3 NH3 (g)
3 NH3 (g)
En la producción de metanol, uno de los compuestos que se obtienen en mayor cantidad a escala planetaria pues es importante en diversos usos como aditivo en las gasolinas sin plomo, como precursor de otros compuestos orgánicos (metanal, ácido acético...) y la síntesis de plásticos y fibras, la reacción entre el H. y el CO tiene lugar a altas presiones (25300 kPa) y temperaturas (600 ºC)) con la presencia de catalizadores como el Al2O3. Modificando el catalizador se pueden conseguir reacciones mas suaves (300 ºC, con un catalizador Cu/Zn).
2H2 (g) + CO (g) ![]() CH3OH (g) ; ΔH = 149.7KJ
CH3OH (g) ; ΔH = 149.7KJ
Otro uso del H. es la hidrogenación de compuestos orgánicos insaturados. El H. se utiliza como un agente reductor de los enlaces dobles del carbono C=C formando aceites saturados y grasas.
Los ácidos grasos insaturados son hidrogenados con H2 utilizando metales finamente divididos como Ni, Pd o Pt como catalizadores. La adición de H2 a los dobles enlaces posibilita que aceites, que son líquidos a temperatura ambiente, se conviertan en grasas sólidas lo que aumenta su valor comercial.
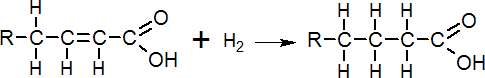
El mecanismo de adición al doble enlace pasa por la disociación homolítica del H. sobre la superficie del catalizador.
En la reducción de menas metálicas se usa Hidrogeno como reductor de óxidos metálicos con el objetivo de obtener metales. Esta actividad es limitada ya que muchos metales económicamente importantes tienen unos potenciales estándar de reducción negativos lo cual hace termodinámicamente desfavorable su reducción por este método. A pesar de ello, la reducción puede llevarse a cabo si las condiciones son ajustadas adecuadamente (elevadas presiones de H2, pHs elevados o si es endotérmica a temperatura). No detallare dicho proceso por carecer de la suficiente importancia.
En cualquier caso, el H. solo es competitivo como reductor en hidrometalurgia (reducciones en medio acuoso) en factorías donde la generación de H2 por ejemplo para la síntesis de amoniaco se realiza a muy bajo costo, en general para la reducción de menas metálicas se sigue utilizando métodos pirometalúrgicos con el C como principal reductor.
También se debe hacer una ligera mención a la producción de H. como gas licuado pues es importante en criogenia y en el estudio de la superconductividad dado que su punto de fusión esta cercano al cero absoluto (-259.2 ºC)