El P es un elemento abundante en la naturaleza (ocupa el lugar 11 entre los más abundantes en la corteza terrestre). Los principales minerales que lo contienen son minerales fosfatados, denominados apatitos: éstos tienen una composición intermedia entre el Ca4(PO4)2X2 y el Ca5(PO4)3X, donde X= F, Cl, OH, ½ CO3 (fluoro, cloro, hidroxo, carbonatoapatitos).
El fósforo es un componente esencial de los huesos y dientes de los animales. Los huesos están formados en su mayoría por fosfato de calcio Ca3(PO4)2. As y Sb aparecen más dispersos, acompañan a otros sulfuros (piritas de arsénico: FeAsS, Sb2S3, Bi2S3 etc). Es uno de los elementos esenciales para la vida junto con el C, H, O, N y S.
Mientras el nitrógeno no presenta ningún alótropo, para el fósforo se conocen dos formas alotrópicas estables (ver sección 16.2.1)
El fósforo blanco, P4, se obtiene industrialmente mediante la reducción electro-térmica (T = 1500 ºC) de la fluorapatita con carbón, en presencia de óxido de sílice. La transformación neta que tiene lugar es
2 Ca3(PO4)2(s) + 6 SiO2(s) + 10 C(s) → P4(g) + 6 CaSiO3(l) + 10 CO(g)
La reacción puede considerarse como una reacción ácido-base, seguida de una reacción redox:
Acido-base: 2 Ca3(PO4)2 + SiO2 → P4O10 + 6 CaSiO3
Reducción: P4O10 + 10 C → P4 + 10 CO
El P4(g) se condensa, se recoge y se almacena bajo agua en forma de un sólido blanco, con aspecto de cera y fosforescente (brilla en la oscuridad) El CaSiO3 separa como escoria. El proceso consume una cantidad ingente de electricidad.
Óxidos y oxoácidos del fósforo
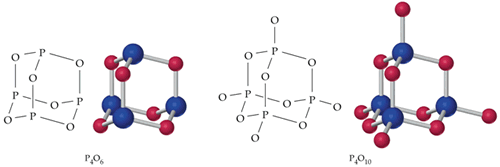
Entre los compuestos más importantes del fósforo están los óxidos y los oxoácidos que tienen fósforo en estado de oxidación +3 y +5. Las fórmulas más simples que podemos escribir para los óxidos son P2O3 y P2O5, respectivamente. Los nombres que les corresponden son “trióxido de fósforo” y “pentóxido de fósforo”, Sin embargo, P2O3 y P2O5 son sólo fórmulas empíricas. Las fórmulas verdaderas de los óxidos son el doble de las escritas, es decir, P4O6 y P4O10.
El P4O10 se forma cuando el P4 blanco reacciona con una cantidad de oxígeno, limitada:
P4(s) + 3O2(g) → P4O6(s)
Este óxido posee átomos de P (en estado de oxidación +3) con geometría tetraédrica, con un átomo de oxígeno de puente entre cada dos átomos de P.
El P4O6 reacciona con agua para formar ácido fosforoso:
P4O6(l) + 6 H2O(l) → 4 H3PO3(ac)
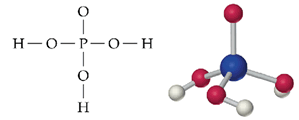
La fórmula del H3PO3 es engañosa porque el ácido sólo tiene dos átomos de hidrógeno ácidos; el tercero está unido al átomo central de P y no se disocia. El ácido fosforoso es un ácido débil en agua pero reacciona completamente en exceso de una base fuerte. Las sales del ácido fosforoso contienen al anión bifosfito, HPO32-.

El P4O10, conocido comúnmente como el pentóxido de fósforo, se forma cuando se quema P4 con un exceso de oxígeno:
P4(s) + 5O2(g) → P4O10(s)
En esta estructura se conserva la unidad tetraédrica de átomos de fósforo en la que además de los átomos de O puentes hay un átomo de oxógeno adicional por cada átomo de P del vértice. Esto significa que hay 10 átomos de O por cada tetraedro P4. Este óxido es un agente desecante muy poderoso y en una reacción exotérmica y vigorosa con el agua, forma ácido fosfórico (H3PO4), uno de los 10 compuestos más importantes en las manufacturas químicas.
P4O10(l) + 6 H2O(l) → 4 H3PO4(ac)
La presencia de muchos enlaces con H hacen que sea una sustancia muy pura y 75 veces más viscosa que el agua. El H3PO es un ácido triprótico débil; en agua pierde un protón pero en exceso de una base fuerte se disocia, completamente en tres paso, para formar los tres oxoaniones fosfatos (H2PO4-, HPO42- y PO43-).
Si se combinan P4O10 y H2O en relación molar 1:6 según la reacción anterior el producto líquido debería ser H3PO4 puro (al 100%). Sin embargo, un análisis del líquido indica que sólo tiene aproximadamente el 87,3% de H3PO4. El fósforo que falta está en el líquido pero como H4P2O7, un compuesto llamado ácido difosfórico o pirofosfórico. Se forma una molécula de ácido difosfórico cuando se elimina una molécula de agua entre dos moléculas de ácido ortofosfórico, como se muestra en la figura:
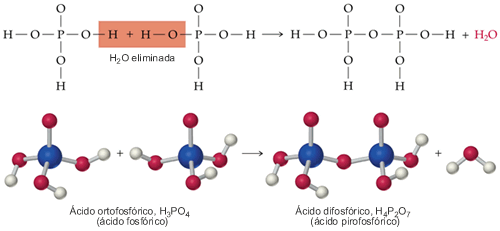
Si se une una tercera molécula de ácido ortofosfórico, eliminándose una molécula de agua, el producto es el ácido trifosfórico, H5P3O10, y así sucesivamente. Las estructuras de cadenas de ácido fosfórico se denominan en su conjunto ácidos polifosfóricos y sus sales se llaman polifosfatos. Hay dos derivados de los ácidos polifosfóricos especialmente importantes que están en elos organismos vivos y se llaman ADP y ATP. La letra A del acrónimo se refiere a la adenosina, una combinación de una base orgánica llamada adenina y un azúcar de cinco átomos de carbono llamado ribosa. Si esta combinación de la adenosina se une a un ion difosfato, el producto es el ADP, difosfato de adenosina. Si se une a un ion fosfato al ADP se obtiene ATP, trifosfato de adenosina.
Síntesis del ácido fosfórico
La mayor parte del ácido fosfórico se obtiene por reacción entre el ácido sulfúrico y el apatito:
3 Ca3(PO4)2·CaF2(s) +
10 H2SO4(ac, conc)+ 20 H2O(l) →
6 H3PO4(ac) + 10 CaSO4·2H2O(s) + 2
HF(ac)
El HF se convierte en Na2SiF6, que es insoluble, y el yeso formado (CaSO4·2H2O) se filtra junto con otras impurezas insolubles. El ácido fosfórico se concentra por evaporación. El ácido fosfórico obtenido mediante este proceso húmedo contiene una gran variedad de iones metálicos como impurezas y es de color verde oscuro o marrón. Sin embargo es adecuado para fabricar fertilizantes y para operaciones metalúrgicas.
Un método alternativo para obtener H3PO4 con una mayor pureza consiste en la combustión del fósforo blanco, P4, con aire, absorbiendo el P2O5 resultante en agua:
P4(s) + 5 O2(g) → P4O10(s)
P4O10(s) + 6 H2O(l) → 4 H3PO4
El ácido fosfórico se obtiene con una concentración entre 54.5 y 61.5 % (contenido de P2O5).
Aplicaciones del ácido fosfórico
La mayor parte del ácido fosfórico (85%) se destina a la fabricación de fertilizantes. El fósforo, junto con el nitrógeno y el potasio, son elementos esenciales para las plantas. El primer fertilizante comercial con alto contenido en fósforo fue el superfosfato triple, que se obtiene por reacción del apatito con ácido fosfórico:
3 Ca3(PO4)2·CaF2(s) +
14 H3PO4(ac, conc)+ 10 H2O(l) →
10 Ca(H2PO4)2·H2O(s) + 2 HF(ac)
Actualmente su importancia en el mercado de los fertilizantes ha disminuido de modo constante en los últimos años. Los fertilizantes con fósforo más importantes son: mezclas de fosfato de monoamonio (MAP), NH4H2PO4 y fosfato de diamonio (DAP), (NH4)2HPO4. Estos fosfatos tienen la ventaja de proporcionar dos nutrientes a las plantas, N y P. Se obtiene por neutralización controlada el H3PO4(ac) con NH3(l).
- Otros usos del ácido fosfórico incluyen sus aplicaciones en la industria de la alimentación; se emplea en la preparación de levaduras y cereales instantáneos, en la fabricación de queso, para curar jamones y para hacer amargos los refrescos.
- Se emplea también para tratar metales haciéndolos más resistentes a la corrosión.
Un problema medioambiental relacionado con el fósforo
Los fosfatos se usan abundantemente como fertilizantes porque el fósforo es un nutriente indispensable para el crecimiento de las plantas. Esta utilización masiva de fertilizantes puede conducir a la contaminación por fosfatos de lagos, estanques y arroyos, provocando una explosión de crecimiento de plantas, especialmente algas. Las algas consumen el oxígeno del agua, llegando a morir los peces. Este tipo de cambio, que ocurre en lagos y arroyos de agua dulce como resultado de su enriquecimiento en nutrientes, se llama eutrofización. Es un proceso natural que tiene lugar en periodos de tiempo geológicos, pero puede ser acelerado en gran medida por la actividad humana.
Una manera de disminuir la aportación de fosfatos al medio ambiente es eliminándolos de las plantas de tratamiento de aguas residuales. Al procesar el agua, los polifosfatos se degradan a ortofosfatos ya sea como fosfatos de hierro (III), fosfatos de aluminio o como fosfato de calcio. La precipitación se lleva a cabo, generalmente, por adición de sulfato de aluminio, cloruro de hierro(III) o hidróxido de calcio (cal apagada). En una planta de tratamiento moderna bien equipada pueden eliminarse de las aguas residuales hasta el 98% de los fosfatos.