La comparación entre el nitrógeno y el fósforo es paralela a la que se hizo entre el oxígeno y el azufre. En general, las diferencias entre el nitrógeno y el fósforo pueden atribuirse a las siguientes características
- Pequeño tamaño del nitrógeno
- Menor electronegatividad del fósforo (3.1) que la del nitrógeno (2.1).
- Presencia de orbitales d de baja energía en la capa de valencia del P
Efecto de la diferencia de tamaño entre N y P: alotropía del fósforo
La relación de tamaño entre el fósforo y el nitrógeno es la misma que existe entre el azufre y el oxígeno, dentro del error experimental. Así, el fósforo es un 60% mayor que el nitrógeno. En consecuencia, los enlaces triple fósforo-fósforo son más débiles que los enlaces triples nitrógeno-nitrógeno, por la misma razón que los enlaces doble S=S son más débiles que los enlaces dobles O=O, esto es el tamaño del fósforo es demasiado grande para que sus átomos se acerquen lo suficiente para formar enlaces múltiples fuertes. En este sentido, el átomo de nitrógeno completa su octeto compartiendo tres pares de electrones con un átomo vecino. No tiene más que una forma alotrópica conocida, N2. Debido a que el fósforo no puede formar enlaces múltiple fuertes consigo mismo, el fósforo elemental (fósforo blanco) consiste en moléculas tetraédricas de composición P4, en la que cada átomo de fósforo forma un enlace sencillo con tres átomos vecinos, como se muestra en la figura:
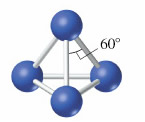
Las unidades básicas estructurales del fósforo blanco son moléculas de P4, en las que los enlaces fósforo-fósforo implican el solapamiento de orbitales 3p casi exclusivamente. Este solapamiento, normalmente, conduce a ángulos de 90º, pero en el P4, los ángulos de enlace P¾P¾P son de 60º. Se dice que estos ángulos están en tensión, y como cabría esperar, las especies con enlaces en tensión son reactivas.
Cuando el fósforo blanco se calienta hasta una temperatura de 300 ºC, en ausencia de aire, se transforma en el fósforo rojo. Lo que parece suceder es que se rompe un enlace P¾P por cada molécula de P4y los fragmentos resultantes se unen formando largas cadenas:
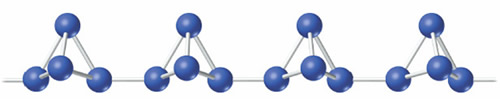
El fósforo rojo es menos reactivo que el blanco y ambos constituyen las dos formas alotrópicas más comunes de este elemento. A pesar de que el fósforo blanco es la forma obtenida al condensar el P4(g) y que la transformación de P blanco en P rojo es un proceso muy lento a la temperatura ambiente, el P rojo es la forma termodinámicamente más estable a 298.15 K. Al P blanco se le asignan los valores de ΔHºf y ΔGºf de cero mientras que para el P rojo dichos valores son negativos.
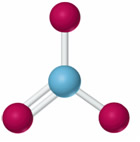
El tamaño del fósforo también interviene en su habilidad para formar enlaces dobles con otros elementos químicos como el oxígeno, el nitrógeno y el azufre. En este sentido, el fósforo tiende a formar compuestos que contienen dos enlaces sencillos P−O mientras que en nitrógeno tiende a formar enlaces dobles N=O. Así por ejemplo, el nitrógeno forma el ion nitrato, NO3-, en el que tiene número de oxidación +5.
Ion nitrato:
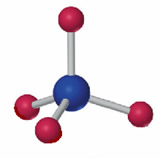
Cuando el fósforo forma un ion en el mismo estado de oxidación, el ion fosfato, PO43- presenta la estructura que se muestra en la figura:
Ion fosfato:
De forma análoga en ácido nítrico HNO3 contiene un doble enlace N=O mientras que el ácido fosfórico, H3PO4, contiene 4 enlaces sencillos P¾O.
Efecto de la diferencia de electronegatividad entre el N y el P
La diferencia de electronegatividad entre el N y el P (0.85) es la misma que existe entre el O y el S (0.86), dentro del error experimental. Debido a que el fósforo es menos electronegativo que el N, es más dado a exhibir estados de oxidación positivos. Mientras que para el nitrógeno se conocen todos los estados de oxidación comprendidos entre el –3 y el +5 (tabla 2), los
estados de oxidación más frecuentes para el fósforo son el +3 y el +5 (y el negativo –3)Tabla 2. Estados de oxidación comunes para el N
Número de oxidación |
Ejemplos |
Número de oxidación |
Ejemplos |
|---|---|---|---|
-3 |
NH3, NH4+ | +1 |
N2O |
-2 |
N2H4 | +2 |
NO |
-1 |
NH2OH | +3 |
N2O3, HNO2 |
-1/3 |
NaAN3 | +4 |
N2O4, NO2 |
0 |
N2 | +5 |
N2O5, HNO3 |
Efecto de la diferencia en la expansión de la capa de valencia en el fósforo.
La reacción química entre el amoniaco y el flúor se detiene en la formación del compuesto NF3(g) porque el nitrógeno emplea sus orbitales de valencia 2px 2py y 2pz para formar los enlaces con el flúor (3 máximo) y completar su octeto. El fósforo, en cambio, tiene orbitales 3d vacíos en su capa de valencia que pueden ser empleados para expandir la capa de valencia de este elemento albergando hasta 10 electrones o más. Cuando el fósforo reacciona con el flúor se forman los compuestos PF3 y PF5. Incluso el fósforo puede formar el ion PF6- en el que el átomo central está rodeado de 12 electrones en su capa de valencia.