Los compuestos del nitrógeno son conocidos desde muy antiguo. Los más importantes desde el punto de vista industrial son: NH3, y HNO3. Por sus implicaciones medioambientales se estudiarán también los óxidos de nitrógeno.
El amoníaco
El nombre de amoníaco deriva del nombre dado a una divinidad egipcia: Amón. Los egipcios preparaban un compuesto, cloruro amónico, a partir de la orina de los animales en un templo dedicado este dios. Cuando se llevó a Europa mantuvo ese nombre en recuerdo de la sal de Amón. A temperatura ambiente es un gas incoloro de un fuerte y característico olor (T eb = -33.4 °C, Tfus = -77.3 °C). Sin embargo es fácil de condensar en amoníaco líquido. El líquido es un buen disolvente de metales alcalinos y alcalinotérreos así como de grasas y sustancias poco polares. Es el gas de mayor solubilidad en agua debido a que es capaz de formar puentes de hidrógeno con ella (1 L de H2O disuelve 727 L de NH3).
La síntesis de amoniaco está muy relacionada con la producción de fertilizantes sintéticos como el sulfato de amonio, nitrato de amonio, urea y fosfatos de amonio.
Síntesis en el laboratorio
El amoníaco se obtiene fundamentalmente mediante la descomposición térmica de sales amónicas:
2 NH4Cl(s) + Ca(OH)2(s) → CaCl2(s) + 2 H2O(l) + 2 NH3(g)
NH4Cl(s) + Na(OH)(s) → NaCl(s) + H2O(l) + NH3(g)
Síntesis industrial
La fijación natural de nitrógeno se realiza a través de la refinada especialidad de ciertas enzimas que se encuentran en las bacterias que viven en las raíces de las plantas o a través de la fuerza bruta de las tormentas eléctricas. Casi el 13% de toda la fijación de nitrógeno sobre la Tierra, se realiza industrialmente mediante el proceso Haber para la formación de amoniaco a partir de sus elementos:
N2(g) + 3 H2(g) ⇔ 2 NH3(g) ΔHº = -91.8 kJ
Convertir el método Haber en un proceso de fabricación fue uno de los problemas de ingeniería más difíciles de su tiempo. Este trabajo fue realizado por Carl Bosch en la Badische Anilin-&Soda-Fabrik (BASF) de Alemania. En 1913 se puso en funcionamiento una planta para producir 30.000 kg de NH3 al día. Fritz Haber y Carl Bosh recibieron el Premio Nobel de química en los años 1918 y 1931.
La dificultad esencial en la reacción de síntesis del amoniaco es que bajo la mayor parte de las condiciones la reacción no es completa. Es una reacción reversible y proporciona una excelente oportunidad para aplicar los principios del equilibrio, y de ver los arreglos necesarios para que el proceso industrial sea económicamente rentable.
De la revisión de la ecuación anterior, podemos observar tres maneras de maximizar el rendimiento de la producción de amoniaco:
- Disminuir la concentración de NH3. Ya que el amoniaco es el producto, eliminarlo conforme se va formando hará que el sistema produzca más, en un intento continuo de mantener el equilibrio.
- Disminuir el volumen (aumento de la presión). Ya que 4 moles de gas reaccionan para producir 2 moles de gas, disminuir el volumen desplazará la posición del equilibro hacia donde hay menor número de moles de gas, esto es, hacia la formación del amoniaco.
- Disminuir la temperatura. Ya que la formación de amoniaco es exotérmica, la disminución de la temperatura (eliminar calor) desplazará la posición de equilibrio hacia el producto, aumentando Kc.
Por tanto, las condiciones ideales para maximizar la producción de amoniaco son: eliminación continua del NH3 conforme se forma, alta presión y baja temperatura. Desafortunadamente, surge un problema que enmarca claramente las diferencias entre los principios del equilibrio y de la cinética. Aunque el rendimiento se favorece a baja temperatura (reacción exotérmica), la velocidad de formación no (reacción muy lenta, puesto que tiene una elevada energía de activación, consecuencia de la estabilidad del N2).. De hecho, el amoniaco se forma tan lentamente a baja temperatura que el proceso no es económicamente viable. En la práctica se logra un arreglo que optimiza en rendimiento y la velocidad. Se usan la alta presión y la remoción continua para aumentar el rendimiento, pero para aumentar la velocidad se aumenta la temperatura hasta un nivel moderado y se emplea un catalizador. Para lograr la misma velocidad sin catalizador, se requiere de mayores temperaturas y resulta en un rendimiento mucho más bajo.
Para alargar la vida del equipo, las plantas modernas de amoniaco operan a presiones de 200-300 atm y a temperaturas de 400-540ºC. Los catalizadores que se emplean en la actualidad son similares a los originales del primer proceso BASF. Esencialmente consisten en óxidos de Fe con pequeñas cantidades de otros óxidos metálicos no reducibles. La composición típica, en peso, de un catalizador de síntesis de NH3 es: Fe3O4 (94.3 %, K2O, 0.8%, Al2O3, 2.3%, CaO, 1.7%, MgO, 0.5%, SiO2, 0.4%). Los catalizadores se preparan fundiendo una mezcla de magnetita y de los promotores (óxidos metálicos) a temperaturas del orden de 1600-2000 ºC, en hornos eléctricos o en un arco eléctrico. El fundido se enfría rápidamente, se pulveriza y se convierte en pequeñas partículas, generalmente de tamaño comprendido entre 6-10 mm.
La reducción de la magnetita es un proceso crucial para la formación del catalizador, Fe elemental:
Fe3O4 + 4 H2 → 3 Fe + 4 H2O.
Esta reacción se lleva a cabo en el reactor a presión por el propio gas de síntesis. Los promotores activos sirven para prevenir la rápida reducción de la magnetita. La concentración de agua producida en la reacción de reducción debe mantenerse baja para evitar que entre en contacto con el catalizador generado y éste envejezca. Los catalizadores son extremadamente sensibles al oxígeno gaseoso y a los compuestos de S, P y Cl, que reducen la actividad catalítica del mismo. La regeneración del catalizador envenenado con O puede hacerse con el propio gas de síntesis, por reducción. La vida media de un catalizador es de 10 años.
La
relación estequiométrica de los gases de reacción comprimidos
(N2:H2 = 1 : 3 en volumen), se inyecta en una caldera,
cámara de reacción presurizada, donde fluye sobre una capa del catalizador.
Algo del calor que se necesita proviene del cambio de entalpía de la reacción. La mezcla en equilibrio que se alcanza, contiene el 35% de amoniaco en volumen, se
enfría con un enfriador de serpentín hasta que el NH3 se condensa
(Pe = -33.4 ºC) y se extrae. Puesto que los puntos de ebullición de N2 y H2 son mucho más bajos, permanecen gaseosos y son reciclados por
bombas de regreso dentro de la cámara de reacción para que el proceso continúe.
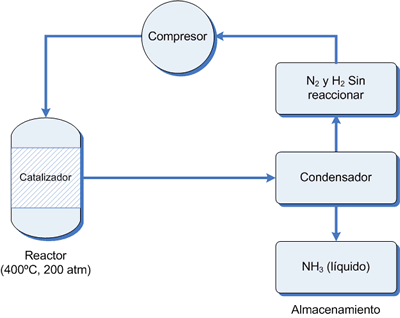
Un aspecto crítico de este proceso es disponer de una fuente de H2(g). Esto se logra principalmente a partir del gas natural.
Aplicaciones del NH3
El amoniaco es el punto de partida para obtener otros muchos compuestos de nitrógeno, pero tiene algunas aplicaciones directas por sí mismo. Su aplicación más importante es como fertilizante. La concentración más alta en la que el fertilizante de nitrógeno puede aplicarse en los campos es como líquido puro de NH3, conocido como “amoniaco anhidro”. El NH3(ac) se aplica también en una variedad importante de productos de limpieza doméstica, tales como limpiacristales comerciales. En estos productos el amoniaco actúa como una base barata para producir OH-(ac). El OH-(ac) reacciona con las moléculas de grasa y aceite para convertirlas en compuestos que son más solubles en agua y que no favorecen la retención de la suciedad. Además, la disolución acuosa de amoniaco se seca rápidamente, dejando pocas rayas sobre el cristal.
La mayor parte del amoníaco (75%) se destina a fabricación de fertilizantes. Los fertilizantes más comunes se forman por neutralización directa del amoniaco (base) con un ácido adecuado:
2 NH3(ac) + H2SO4(ac) → (NH4)2SO4(s)
2 NH3(ac) + H3PO4(ac) → (NH4)3PO4(s)
El cloruro de amonio, obtenido por reacción entre el NH3(ac) y el HCl(ac), se utiliza en la fabricación de pilas secas, en limpieza de metales, y como un agente para facilitar el flujo de la soldadura cuando se sueldan metales. El nitrato de amonio, obtenido por reacción entre el NH3(ac) y el HNO3(ac), se utiliza como fertilizante y como explosivo. El poder explosivo del nitrato de amonio no fue totalmente apreciado hasta que un cargamento de este material explotó en la ciudad de Texas, en 1947, matando a muchas personas.
Una parte importante de la producción de amoniaco (15%) se destina a la fabricación de la urea (NH2)2C=O.
2 NH3 + CO2 → (NH2)2CO + H2O
La urea contiene un 46% de nitrógeno, en masa y es un excelente fertilizante, bien como sólido puro, o bien como sólido mezclado con sales de amonio, o en disolución acuosa muy concentrada mezclada con NH4NO3 o NH3(o con ambos). La urea también se utiliza como un suplemento del pienso para el ganado y la producción de polímeros y pesticidas. Actualmente la urea aparece clasificada en séptimo lugar entre los productos químicos más fabricados, en masa, en los Estados Unidos; el nitrato de amonio se clasifica el quinto y el sulfato de amonio el trigésimo primero (basado en datos de 1995).