El fósforo, al igual que ocurre con el S, se presenta en varias formas alotrópicas. Sus propiedades (aspecto e incluso reactividad) varían sustancialmente de unas a otras. Todas ellas contienen enlaces sencillos P–P.
a: fusión + sublimación a vacío
b: calentamiento >250oC
c: calentamiento 220oC bajo P
d: evolución espontánea
e: 25ºC P elevadas
Fósforo blanco
El fósforo blanco fue la sustancia que obtuvo H. Brandt.
Propiedades
Es una sustancia molecular, constituida por moléculas de P4 en las que los átomos de P se disponen de forma tetraédrica
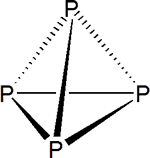
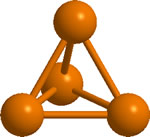
Al ser un sólido molecular los puntos de ebullición y fusión (44ºC y 280ºC, respectivamente) son bajos. El sólido tiene elevada presión de vapor y tiene un aspecto como de cera.
Es blando y soluble en disolventes no polares (CS2) o poco polares (el rojo y el negro no lo son). Es insoluble en agua. Se almacena bajo ella para prevenir su oxidación (las otras formas son estables en contacto con el aire).
Es muy tóxico (dosis letal 0.1 g). Provoca necrosis de la mandíbula y una muerte lenta y dolorosa. No se debe permitir su contacto con la piel.
Reactividad
Es un sólido metaestable. Pblanco ![]() Projo (DH = -17 kJ/mol). Cuando se le expone a
radiación UV el P blanco evoluciona lentamente al P rojo.
Projo (DH = -17 kJ/mol). Cuando se le expone a
radiación UV el P blanco evoluciona lentamente al P rojo.
Es la variedad del fósforo más reactiva. Probablemente debido a las tensiones estéricas de la molécula (ángulos P-P-P=60o). Este ángulo es mucho más cerrado de lo que es habitual en un átomo trivalente. Un ángulo tan pequeño significa un peor solapamiento entre los orbitales atómicos, por eso el enlace P–P en el P4 es tan débil.
Arde en contacto con el aire a temperaturas por encima de 35ºC, es por esto que se ha utilizado para fabricar ingenios incendiarios. En una atmósfera húmeda, por debajo de 35 ºC, la reacción de oxidación transcurre lentamente y es la causante del fenómeno observado por primera vez por el químico que lo aisló. El óxido se forma en un estado electrónicamente excitado y es cuando los electrones decaen a su estado fundamental cuando se emite luz (fosforescencia).
P4 (s) + 5
O2 (g) ![]() P4O10 (s)
P4O10 (s)
Como ya se ha avanzado, el fósforo blanco se obtiene por reducción de fosfato cálcico con carbón, utilizándose el dióxido de silicio para capturar el Ca en forma de silicato cálcico. La reducción con carbón requiere una elevada temperatura a pesar de que la reacción es exotérmica (DH=-3060 kJ).
2 Ca3(PO4)2 (s) + 10 C (s) + 6 SiO2 (s) 1500 ºC![]() P4 (g) + 10 CO
(g) + 6 CaSiO3 (l)
P4 (g) + 10 CO
(g) + 6 CaSiO3 (l)
¿Por qué existe el P4 y no el N4?
Argumento termodinámico
A partir de la tabla de energías de enlace podemos calcular las variaciones entálpicas asociadas a los procesos de formación de ambas moléculas que claramente favorecen la formación del P4 frente a la del N4.
2P2(g)
![]() P4(g) DHo=
-220 kJ mol-1
P4(g) DHo=
-220 kJ mol-1
2N2(g)
![]() N4(g) DHo=
930 kJ mol-1
N4(g) DHo=
930 kJ mol-1
Argumento Estérico
Las tensiones estéricas, ya grandes en el P4, aumentarían en el N al ser este más pequeño.
Fósforo rojo
Si calentamos (270-300ºC) el fósforo blanco en ausencia de aire se obtiene el P rojo. Es una sustancia amorfa, más densa, más dura, con un punto de fusión mucho mayor (600ºC).
Es menos tóxica y reactiva que la forma blanca. Puede ser almacenada en presencia de aire sin que reaccione con el.
Está formado por redes tridimensionales con cada átomo de fósforo en un entorno piramidal. Debido a ello el fósforo rojo es insoluble y su temperatura de fusión es mayor (600oC) que la del blanco.
La densidad del fósforo rojo también es mayor que la del blanco
Reactividad
Es termodinámicamente más estable que el P4 y, por tanto, menos activo desde un punto de vista químico. Arde en contacto con el aire sólo si calentamos a temperaturas aproximadas de 400ºC. No hay peligro de combustión al aire en condiciones normales
Cuando se calienta bajo presión (1.2 GPa) se forma una variedad negra (fósforo negro), más densa y aún menos reactiva con estructura tridimensional. Es la forma alotrópica más estable termodinámicamente. Tiene propiedades de semiconductor. Estructuralmente recuerda al grafito.
P4 (blanco) (300 ºC) ![]() P rojo (200ºC,12000 atm)
P rojo (200ºC,12000 atm) ![]() P negro
P negro