Los oxoácidos de fósforo son de gran importancia industrial y biológica.
Son muy numerosos (sólo el silicio presenta mayor número de combinaciones de este tipo). Todos ellos contienen el átomo de P tetracoordinado. En los ácidos de P(V), las cuatro posiciones están ocupadas por oxígenos, mientras que encontramos enlaces P–H y P–P en los oxoácidos y oxosales de P(I) y (III).
Los principios estructurales que los rigen son sencillos:
- Todos los átomos de P son están tetraédricamente coordinados (hibridación sp3). Formación de enlaces s. Se forman enlaces dobles entre el P y los oxígenos terminales (enlace P=O).
- Todos los átomos de P tienen uno o más grupos P-OH. Estos protones son ionizables.
- Algunas especies tienen uno o más enlaces P-H. Estos hidrógenos no son ionizables.
- La catenación se produce mediante puentes de oxígeno P-O-P y menos frecuentemente de modo directo P-P. El enlace P-O sencillo es un enlace fuerte y se le considera como la reserva energética primaria de los sistemas biológicos.
- Los peroxocompuestos pueden tener grupos P-O-O-H o bien grupos P-O-O-P. Podemos dividir los oxoácidos en dos grupos: los simples formados por tetraedros aislados de P enlazado a O u OH y los condensados: formados por más de un tetraedro de P unidos entre sí por puentes P–O–P o por enlaces directos P–P.
Oxoácidos sencillos
Formados por tetraedros aislados de fósforo enlazado a átomos de -O o grupos -OH. Los más importantes y sus correspondientes aniones se resumen en la tabla siguientes:
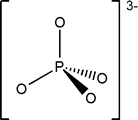
Ortofosfórico
(Fosfórico) ácido triprótico débil |
H3PO4 |
Fosfato; P(V) |
PO43- |
Fosfato (ortofosfato)
K1 =7.10-3 K2 =6.10-8 K3 =4.10-13 |
 |
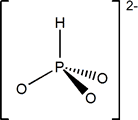
Fosforoso ácido diprótico débil |
(OH)2[HPO] |
Fosfito; P(III) |
HPO32- |
Fosfito
K1 =8.10-3 K2 =2.10-7 |
 |
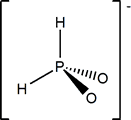
Hipofosforoso
ácido monoprótico débil |
(OH)[H2PO] |
Hipofosfito; P(I) |
H2PO2- |
Hipofosfito K1 =8.5.10-2 |
 |
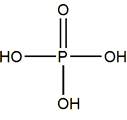
El ácido más importante es el ortofosfórico:
 |
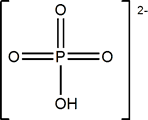 |
ácido ortofosfórico |
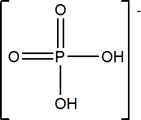
ión monohidrogenofosfato |
 |
 |
ión dihidrogenofosfato |
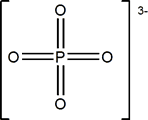
ión fosfato |
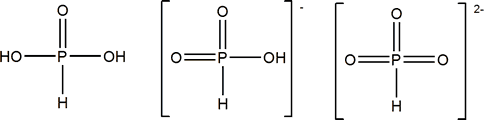
ácido fosforoso (diprótico)
Ácido ortofosfórico
El ácido ortofosfórico, o simplemente fosfórico, es un compuesto sólido (P.f.= 42ºC). Se comercializa en disoluciones al 86% en agua.
Es uno de los compuestos más importantes de P. Sus sales, los fosfatos, son las especies más estables de P y es la forma en la que habitualmente se presenta en la naturaleza.
Obtención
Se obtiene a partir del fosfato cálcico, por tratamiento con ácido sulfúrico:
Ca3(PO4)2 + 3 H2SO4 ![]() 2 H3PO4 + 3
CaSO4
2 H3PO4 + 3
CaSO4
Debido a las impurezas del mineral, el fosfórico obtenido es bastante impuro. El sulfato cálcico generado puede constituir un problema ya que su producción excede el consumo y terminan generándose inmensos depósitos del mismo.
Método alternativo para obtenerlo con una mayor pureza:
P4 ![]() P4O10
P4O10 ![]() H3PO4
H3PO4
P4 + O2 ![]() P4O10
P4O10
P4O10 + 6 H2O ![]() 4 H3PO4
4 H3PO4
Características
El ácido puro es un sólido cristalino. Es muy estable y no manifiesta propiedades oxidantes.
Es fuertemente higroscópico y muy soluble en agua (se disuelve en agua sin gran desprendimiento de calor). Las fuertes interacciones por puente de hidrógeno dan a sus disoluciones un aspecto siruposo (aceitoso).
Cuando se calienta sufre una parcial deshidratación formando el ácido difosfórico (o pirofosfórico).
2 H3PO4 ![]() H2O + H4P2O7
H2O + H4P2O7
la condensación puede continuar dando otros grados de condensación
H3PO4 + H4P2O7![]() H2O + 2
H5P3O10
H2O + 2
H5P3O10
El H3PO4 recientemente fundido presenta una conductividad iónica apreciable, lo que se atribuye a fenómenos de autoprotonación tales como los siguientes
2 H3PO4 ![]() H4PO4+ + H2PO4-
H4PO4+ + H2PO4-
La especie aniónica contribuye al transporte de carga por intercambio de protones con las moléculas neutras H3PO4.
En disolución acuosa el H3PO4 se comporta como un ácido moderadamente fuerte en la disociación del primer protón. Las siguientes constantes son menores.
H3PO4 + H2O ![]() H3O+ + H2PO4-
pK1=2.15
H3O+ + H2PO4-
pK1=2.15
H2PO4- + H2O ![]() H3O+ + HPO42- pK2=7.20
H3O+ + HPO42- pK2=7.20
HPO42- + H2O ![]() H3O+ + PO43- pK3=12.3
H3O+ + PO43- pK3=12.3
En la valoración con una base, las dos primeras inflexiones son a pH 4.5 (naranja de metilo) y 9.5 (fenolftaleina). La tercera inflexión no se puede detectar ya que ocurre a pH muy alto.
Usos del ácido fosfórico
- La mayor parte del ácido fosfórico (85%) se destina a la fabricación de fertilizantes. El fósforo, junto con el nitrógeno y el potasio, son elementos esenciales para las plantas.
- Sustituyente del ácido cítrico o tartárico en bebidas del tipo limonada.
- Aditivo en bebidas embotelladas en contenedores metálicos (los iones metálicos forman los inertes fosfatos previniendo un eventual envenenamiento por metales).
- Eliminación de la herrumbre de metales: 2 H3PO4 (ac) + Fe2O3 (s)
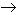 2 FePO4 (s)
+ 3 H2O (l).
2 FePO4 (s)
+ 3 H2O (l).
Ortofosfatos
Existen tres series de sales derivadas del ácido ortofosfórico que, en el caso de cationes
monopositivos, tienen la fórmula:
MIH2PO4: dihidrogenofosfato
MI2HPO4: hidrogenofosfato
MI3PO4: ortofosfato
El ión tetraédrico ortofosfato, como el silicato, puede formar cadenas y redes originando los denominados fosfatos condensados.
Existen fosfatos de la mayoría de los iones metálicos y no metálicos. Algunos de ellos son de gran importancia ya sean hidratados o deshidratados: los amónicos como fertilizantes, los alcalinos como mezclas tampón.
Cuando se utilizan debemos ser conscientes de sus propiedades ácido-base porque la hidrólisis de sus aniones puede alterar el pH de la disolución.
PO4-3 |
> |
HPO4-2 |
> |
H2PO4- |
|
| Kb | 2.2 10-2 |
1.6 10-7 |
1.4 10-12 |
||
| pH | básico |
ácido |
Ácido |
Fertilizantes
Tratando la fosforita con H2SO4 se obtienen el superfosfato (mezcla de yeso (50%) y las sales cálcicas solubles de HPO4-2(32%) y H2PO4-(3%)):
Ca3(PO4)2 + 2 H2SO4 |
2
CaSO4 + CaHPO4 |
|
insoluble |
soluble |
Si en lugar de ácido sulfúrico, se trata con H3PO4 un fosfato bruto que contenga mucho CaCO3 (lo cual es muy habitual), se obtiene el superfosfato triple (evitamos la formación del sulfato cálcico inerte):
Ca3(PO4)2 + CaCO3 + 6 H3PO4 ![]() 4 Ca(H2PO4)2 + CO2 + H2O
4 Ca(H2PO4)2 + CO2 + H2O
Si se utiliza HNO3, se neutraliza luego el exceso con NH3 y se añade KCl, se obtiene el NITROPHOSKA, un abono mezcla de Ca(H2PO4)2, NH4NO3 y KCl muy completo pues contiene los tres elementos esenciales para las plantas: N, K y P.
El uso masivo de fertilizantes fosfatados y también de detergentes que contienen fosfatos trae consigo el problema de la EUTROFIZACIÓN. Es necesario eliminarlos de las aguas residuales.
Una forma de hacerlo es tratarlas con hidróxido cálcico:
5 Ca(OH)2 +
3 HPO4-2![]() Ca5(PO4)3(OH) (insoluble) + 6
OH- + 3 H2O
Ca5(PO4)3(OH) (insoluble) + 6
OH- + 3 H2O
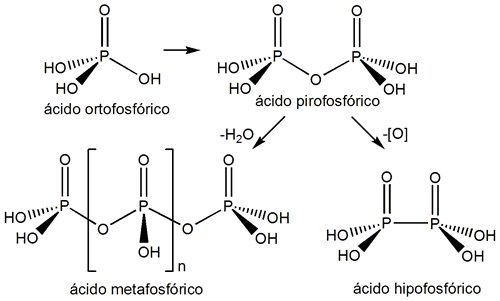
Ácido fosforoso
Según la nomenclatura IUPAC se nombra como ácido fosfónico y sus sales como fosfonatos. Como el fosfórico es un sólido blanco (P.f.=70.1 ºC). Es un ácido débil diprótico.
Se obtiene por hidrolisis de PCl3 o P4O6.
PCl3 + 2 H2O
![]() 3 HCl + HPO(OH)2
3 HCl + HPO(OH)2
P4O6 + 6 H2O ![]() 4 HPO(OH)2
4 HPO(OH)2
Es un reductor especialmente fuerte en medio básico.
PO43- + 2
H2O + 2 e- ![]() 3 OH- + HPO32- Eo =
-1.1V
3 OH- + HPO32- Eo =
-1.1V
H3PO4 + 2 H+ + 2 e-![]() H2O + HPO(OH)2 Eo = -0.28V
H2O + HPO(OH)2 Eo = -0.28V
Ácido hipofosforoso
Es un ácido monobásico, fuertemente reductor. Su anión, H2PO2-, puede obtenerse cuando el fósforo blanco reacciona con una disolución de una base en caliente:
P4 (s) + 4 OH- + 4 H2O ![]() 4 H2PO2- (ac)
+ 2 H2 (g)
4 H2PO2- (ac)
+ 2 H2 (g)
Oxoácidos condensados sencillos
Una de las características generales de los ácidos fosfórico y fosforoso es su tendencia a sufrir reacciones de condensación cuando se calientan. Una reacción de condensación es aquella en la que dos o más moléculas se combinan para formar una molécula más grande eliminando una molécula pequeña. Cuando la molécula eliminada es H2O se denominan tambien reacciones de deshidratación. Por deshidratación del ácido ortofosfórico podemos obtener el ácido pirofosfórico y ulteriormente el hipofosfórico:
Hipofosfórico P(V) |
(OH2)OP-PO(OH2) |
Hipofosfato: |
P2O64- |
Difosfórico o Pirofosfórico P(V) |
(OH2)P-O-P(OH2) |
Difosfato o Pirofosfato: |
P2O74- |
Por oxidación del fósforo rojo en medio básico se puede obtener la sal sódica del ácido hipofosfórico; si acidificacmos se puede aislar la forma ácida.
Por condensación (deshidratación) del ácido ortofosforoso (o fosforoso o mejor fosfónico) podemos obtener el ácido pirofosforoso:
Hipofosforoso P(III) |
(OH)[H2OP] |
Hipofosfito |
[H2OP]- |
Pirofosforoso P(III) |
(OH)[HOP]-O-[PHO](OH) |
Pirofosfito |
[P2O3H2]-2 |
Los prefijos que usualmente se utilizan para denominar a estos compuestos son:
Prefijo hipo: se refiere a un menor contenido en oxígeno que el ácido original.
Prefijo piro: dímero formado por la pérdida de una molécula de H2O.
Prefijo meta: entidad formada por la pérdida de al menos 2 moléculas de H2O.
Fosfatos condensados
La deshidratación térmica de las sales de fosfatos que contienen los grupos P-OH constituye un método general de producción de polifosfatos. En estas entidades debemos tener más de un enlace P-O-P.
En general los polifosfatos consisten en una secuencia de tetraedros de fosfato PO4-3 unidos por sus vértices mediante puentes P-O-P y que estructuralmente recuerdan a los silicatos.
Las unidades básicas para la construcción de los fosfatos condensados se muestran a continuación.
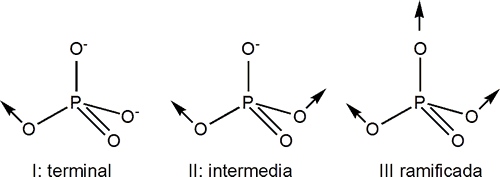
Estas unidades pueden asociarse para dar:
Metafosfatos: agrupaciones de unidades de tipo II formando anillos (cadenas cerradas).
Ejemplo Na3P3O9 (trimetafosfato de sodio).
Polifosfatos: agrupaciones del tipo I y II (terminal e intermedia) para formar cadenas abiertas.
Los que poseen un número de átomos entre 2 y 10 pueden aislarse por cromatrografía.
Ejemplo Na5P3O10 (trifosfato de sodio). Se pueden obtener altos polímeros n>1000.
Ultrafosfatos ramificados: contienen agrupaciones del tipo I, II y III.
+5 |
H5P3O10 |
Trifosfórico (TPF) |
+5 |
Hn+2PnO3n+1 |
Polimeta fósforico |
+5 |
(HPO3)3 |
Ciclo-Trimeta fosfórico |
Se han identificado muchos polifosfatos lineales formas estructuras en estado sólido dependen de la naturaleza de los cationes presentes. Esta diversidad estructural se debe esencialmente al número ilimitado de variaciones conformacionales entre las unidades de fosfato: RbPO3, LiPO3, NaPO3, CuK2(PO3)4.
Mencionar finalmente dos compuestos con presencia del grupo peroxo:
+5 |
H3PO5 |
Peroxomono fosfórico |
+5 |
H4P2O8 |
Peroxodifosfórico |