Concatenación en el fósforo: anillos
Como acabamos de reseñar el P tiene una gran apetencia por formar enlaces sencillos. Por tanto origina una mucho más variada familia de compuestos homocatenados que el N y que son estables. Presenta estructuras cíclicas como las siguientes:
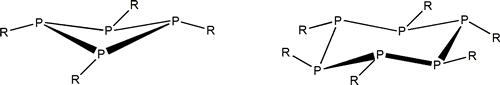
Algunos compuestos cíclicos del fósforo
La tendencia a la formación de cadenas disminuye progresivamente conforme bajamos en el grupo debido a que la energía del enlace E-E disminuye (mayor radio atómico, peor solapamiento)
Cerillas
La combustión espontánea del fósforo blanco en aire lo hizo objeto de una gran fascinación en el pasado. Se realizaron notables esfuerzos para fabricar lo que en la actualidad conocemos como cerillas. En la actualidad utilizamos con tal naturalidad las cerillas que es difícil imaginar la vida antes de que se dispusiera de cerillas seguras y baratas.
Las actuales cerillas son las que conocemos como fósforos de seguridad. Fueron inventadas en 1855 por J.E. Lundstrom (Suecia). La cabeza de la cerilla contiene esencialmente un agente oxidante como el KClO3 así como sulfuro de antimonio (III) mientras que en la superficie de fricción está compuesta por P (rojo) (mucho más seguro que el blanco inicialmente utilizado), compuestos de S (Sb2S3) y óxido de hierro (III).
Raspando la cerilla sobre la cinta que contiene el P rojo, una pequeña cantidad del mismo se transforma en P blanco que se inflama instantáneamente. El calor generado a su vez enciende los compuestos de la cabeza de la cerilla.
Existen otras cerillas que pueden ser encendidas en cualquier sitio (cabeza blanca) y que fueron inventadas en 1889. La cabeza contiene el clorato de potasio, el trisulfuro de tetrafósforo
P4S3) y óxidos de cinc y hierro. Cualquier fricción puede proporcionar la energía de activación necesaria para iniciar la rápida reacción entre el KClO3 y el P4S3 (oxidante y reductor). La combustión del P4S3 es extraordinariamente exotérmica:
P4S3 (s) + 8 O2 (g) ![]() P4O10 + 3 SO2 (g): DH =
-3616 kJ
P4O10 + 3 SO2 (g): DH =
-3616 kJ
El fósforo ha sido utilizado en una gran variedad de productos incendiarios. Un ejemplo lo constituye el famoso Cóctel Molotov: combinación de P y gasolina, almacenados en una botella.
Cuando esta se rompe el fósforo prende la gasolina produciendo un agente incendiario efectivo y barato.
Reactividad del fósforo comportamiento redox
A pesar de que P y N son vecinos en la tabla periódica, su comportamiento redox es muy diferente:
Mientras que los estados de oxidación altos del N son muy oxidantes en medio ácido, los de fósforo son bastante estables (incluso más estables que los estados de oxidación más bajos)
La mayoría de los compuestos de P son reductores (pendientes negativas en el diagrama de Frost)
El elemento P4 como tal es inestable frente a estados de oxidación superior e inferior: Por tanto el P4 desproporciona según la reacción:
4
P(0) ![]() P(-3) + 3 P(1)
P(-3) + 3 P(1)
P4 + 3OH-(ac) + H2O ![]() PH3(g) + 3H2PO2-(ac)
PH3(g) + 3H2PO2-(ac)
Algunas reacciones comunes para los elementos del grupo 15
Hidrógeno
N2 (g) + 3
H2 (g) ![]() 2 NH3 (g)
2 NH3 (g)
P4 (g) + 6
H2 (g) ![]() 4 PH3 (g)
4 PH3 (g)
Oxígeno
N2 (g) + x
O2 (g) ![]() 2 NOx (g)
2 NOx (g)
P4 (g) + x
O2 (g) ![]() 2 P4O2x (g); x=3, 5
2 P4O2x (g); x=3, 5
4 As (s) + 3 O2 (g)
![]() 2 As4O6 (s)
2 As4O6 (s)
4 E (s) + 3 O2 (g)
![]() 2 E4O3 (s); E=Sb, Bi)
2 E4O3 (s); E=Sb, Bi)
Agua
No hay reacción
Halógenos
3 E(s) + 3 X2 (s,
l, g) ![]() 2 EX3 (s, l); E=P, As, Sb, Bi
2 EX3 (s, l); E=P, As, Sb, Bi
3 E(s) + 5 X2 (s,
l, g) ![]() 2 EX5 (s, l); E=P, As, Sb
2 EX5 (s, l); E=P, As, Sb
| Estado oxidación | (+5) |
(+3) |
(+1) |
(0) |
(-3) |
||||
| M. Ácido pH = 0 |
H3PO4 |
-0.276 |
H3PO3 |
-0.499 |
H3PO2 |
-0.508 |
P |
-0.063 |
PH3 |
| M. Básico
pH = 14 |
PO4-3
|
-1.12 |
HPO3-2 |
-1.57 |
H2PO2-
|
-2.05 |
P |
-0.89 |
PH3 |