El fósforo forma un gran número de óxidos, sulfuros y oxosulfuros. Sus estructuras, en estado gaseoso, derivan del mismo modelo estructural basado en el tetraedro de P4:
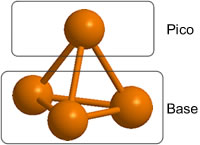
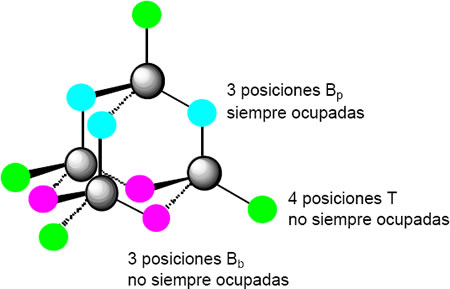
Seleccionemos arbitrariamente uno de los P como en la posición apical (p); los tres restantes los denominamos P basales. Entre los 3 fósforos basales hay 3 posiciones que denominamos Bb; entre los fósforos basales y el apical hay 3 posiciones, Bp; finalmente hay 4 posiciones terminales T asociadas a cada uno de los cuatro fósofors. Pues bien, O y S pueden ocupar cualquiera de estas posiciones Bb, Bp o T formando los óxidos sulfuros o incluso compuestos mixtos de diferente estequiometría.
Compuesto ocupación de posiciones
T |
Bb |
Bp |
||||
|---|---|---|---|---|---|---|
O |
S |
O |
S |
O |
S |
|
P4O10 |
4 |
- |
3 |
- |
3 |
- |
P4O6 |
1 |
- |
3 |
- |
3 |
- |
P4O7 |
1 |
- |
3 |
- |
3 |
- |
P4S3 |
- |
- |
- |
- |
- |
3 |
P4O4S6 |
4 |
- |
- |
3 |
- |
3 |
P4O6S4 |
- |
4 |
3 |
- |
3 |
- |
P4S6 |
- |
1 |
2 |
- |
- |
3 |
Óxidos de fósforo
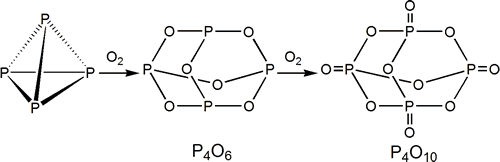
Probablemente los compuestos más representativos de fósforo son aquellos en los que el elemento está combinado de alguna manera con el oxígeno. Los óxidos más importantes son el P4O6 (P(III)) y P4O10 (P(V)), aunque se conoce la serie P4On (6<=n<=10). Todos ellos reaccionan ávidamente con el agua formando oxoácidos.
Tanto el P4O6 como el P4O10 son sólidos blancos que se forman por reacción directa con oxígeno dependiendo de las condiciones de reacción.
P4 + 3 O2 ![]() P4O6
P4O6
P4 + 5 O2 (exceso) ![]() P4O10
P4O10
Los enlaces P-O (como los S-O y los Si-O) sencillos son muy fuertes debido a que están reforzados por retrodonación dp-pp. Por ello para el P es energéticamente más favorable formar dos enlaces sencillos P-O que uno doble P=O. Los enlaces P-O terminales tienen carácter de doble enlace.
Contribuciones σ y π a dobles enlaces (kJmol-1)
B-O |
C-O |
N-O |
|
536/? |
335/380 |
190/370 |
|
Si-O |
P-O |
S-O |
|
420/170 |
335/150 |
275/250 |
P4O10: Su propiedad más importante y la que le confiere su uso principal es su gran afinidad por el agua (reacciona violentamente con el agua líquida). Es uno de los más poderosos deshidratantes conocidos. El resultado de esta reacción es el ácido ortofosfórico (ácido triprótico débil): H3PO4.
P4O10 (s) + 6 H2O (g) ![]() H3PO4
H3PO4
P4O6: en estado sólido se desconoce su estructura. Es soluble en disolventes tipo benceno o CS2. Es el anhídrido del ácido fosforoso: H3PO3 (ácido diprótico débil)
Los óxidos del grupo 15 constituyen un ejemplo claro de dos aspectos que tambien se manifiestan en otros grupos de la Tabla Periódica:
La estabilidad de los estados de oxidación superiores decrece a medida que aumenta el número atómico
Dado un cierto estado de oxidación, el carácter metálico de los elementos y consecuentemente el carácter básico de los óxidos, se hace cada vez mayor a medida que aumenta el número atómico. Los óxidos de P(III) y As(III) son ácidos, el de Sb(III) es anfótero y el de Bi(III) es definidamente básico.
Sulfuros
Se conocen sulfuros de P de composición P4Sn (n=3, 4, 5, 7, 9, 10). Todos ellos son sólidos y amarillos.
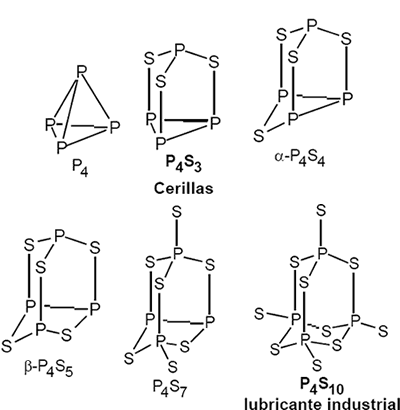
Como hemos dicho sus estructuras moleculares son el resultado de la inserción de átomos de S en los tetraedros P4. El P4S10 es isoestructural con el óxido y reacciona con el agua de forma semejante.`
P4S10 + 16 H2O ![]() 4 H3PO4 + 10 H2S
4 H3PO4 + 10 H2S
El P4S3 se utiliza en la fabricación de cerillas. Formulación: KClO3 (20%), P4S3 (9%), Vidrio molido (14%), Fe2O3 (11%), ZnO (7%), adhesivos (10%).
P4S3 (s)
+ 8 O2 (s) ![]() P4O10 (s) + 3 SO2 (s) ΔH=-3616 kJ
P4O10 (s) + 3 SO2 (s) ΔH=-3616 kJ
Los sulfuros de P se utilizan para la síntesis de los compuestos organofosforados, utilizados como pesticidas y en la fabricación de gases para la guerra química (gas Sarin, entre otros).